CaCl2常用于冬季道路除雪,建筑工业的防冻等,实验室常用作干燥剂。工业上常用大理石(含有少量Al3+、Fe2+、Fe3+等杂质)来制备。下图为实验室模拟其工艺流程:
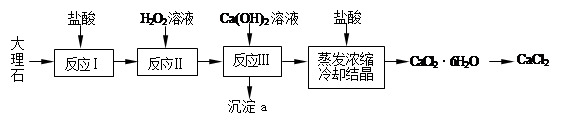
已知:常温下,溶液中的Fe3+、Al3+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,4,9.7。
(1)写出反应Ⅰ中主要反应的离子方程式: 。
(2)反应Ⅱ中的化学方程式: 。
(3)反应Ⅲ中必须控制加入Ca(OH)2的量,使溶液的pH约为8.0,此时沉淀a的成分为: ,若pH过大,则可能发生副反应的离子方程式: 。
(4)实验用所示装置进行反应Ⅰ时,利用制取CO2进行有关性质实验,

①若烧杯中溶液为硅酸钠,则实验现象为
②若烧杯中溶液为偏铝酸钠溶液,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。
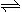 2NO2 (g) ΔH<0,
2NO2 (g) ΔH<0,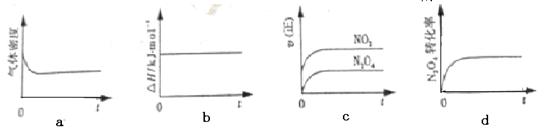

 粤公网安备 44130202000953号
粤公网安备 44130202000953号