在如下图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备Fe(OH)2。
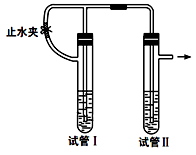
(1)在试管I中加入的试剂是 。
(2)为了制得Fe(OH)2白色沉淀,在试管I和Ⅱ中加入试剂,打开止水夹,塞紧塞子后观察到试管I产生大量气体。一段时间后,检验到试管Ⅱ支管出口的气体只有一种时,再进行的操作是 ,使试管I中的溶液进入到试管Ⅱ中溶液底部,产生Fe(OH)2。
(3)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
(4)反应结束后,将Fe(OH)2沉淀倒出,在空气中迅速变为灰绿色,最后变为红褐色,其原因是 (用化学方程式表示)。
过氧化碳酰胺(CO(NN2)2·H2O2)是一种白色晶体,易溶于水和有机溶剂,稍高温度时(>45℃)即分解,可作为高效、安全、方便的固体消毒剂。工业上常用湿法合成,工艺流程如下:
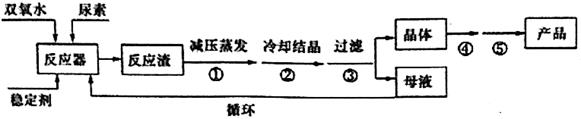
(1)反应器中发生的反应为:CO(NH2)2+H2O2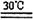 CO(NN2)2·H2O2 △H <0,应采取_______方式加热,从母液中循环利用的物质为________。
CO(NN2)2·H2O2 △H <0,应采取_______方式加热,从母液中循环利用的物质为________。
(2)操作①采用减压蒸发的原因是________,操作④、⑤名称为________、________。
(3)过氧化碳酞胺也可用干法流程制取:
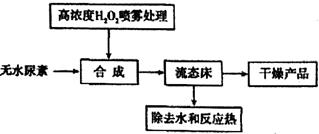
与湿法工艺对比,干法工艺的优点是________,缺点是________。
(4)为测定产品的纯度,称取3.0 g产品于锥形瓶中,加适量蒸馏水溶解,再加入几滴H2SO4,用0.2500 mol/L KMnO4标准溶液滴定,终点时消耗标准溶液40.00 mL〔己知:尿素与KMnO4溶液不反应)。
①完成并配平方程式:______MnO4-+______H2O2+ ______H+=_______Mn2 ++_____H2O+______
②产品纯度为________(结果保留到小数点后一位)。
某化工厂尝试用软锰矿、闪锌矿(含有Fe、Cu、 Al等元素杂质)联合制备工业产品MnO2和Zn。(已知:软锰矿的主要成分为MnO2,闪锌矿主要成分为ZnS。)
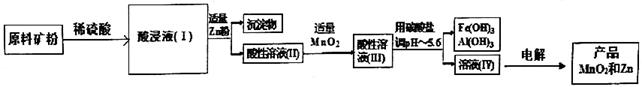
(1)原料需加工成矿粉的原因是________。
(2)己知MnO2有较强的氧化性,在酸性溶液中能氧化金属硫化物生成硫单质,请写出原料矿粉加稀硫酸后所发生的主要反应________。
(3)酸浸液(I)中含有的金属阳离子有Mn2+、Fe3+、Zn2+、________、________。
(4)酸性溶液(II)中加入适量MnO2的作用是________;酸性溶液(Ⅲ)中所加的碳酸盐可选用________ (填序号)。
①Na2CO3 ②MnCO3 ③ZnCO3 ④CaCO3
(5)电解溶液Ⅳ后阳极产物为________,若电解过程转移lmol电子,则理论上阴极产物的质量为________g。
草酸亚铁为黄色固体,作为一种化工原料, 可广泛用于涂料、染料、陶瓷、玻璃器皿等的着色剂以及新型电池材料、感光材料的生产。合成草酸亚铁的流程如下:

(1)配制(NH4)2Fe(SO4)2溶液时,需加入少量稀硫酸,目的是 。
(2)得到的草酸亚铁沉淀需充分洗涤,检验是否洗涤干净的方法是 。
(3)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行加热分解,结果如下图(TG%表示残留固体质量占原样品总质量的百分数)。
①则A→B发生反应的化学方程式为: 。

②已知B→C过程中有等物质的量的两种气态氧化物生成,写出B→C的化学方程式 ;
(4)某草酸亚铁样品中含有少量草酸铵。为了测定不纯产品中草酸根的含量,某同学做了如下分析实验:
Ⅰ.准确称量m g样品,溶于少量2mol/L硫酸中并用100mL容量瓶定容。
Ⅱ.取上述溶液20mL,用c mol/L高锰酸钾标准溶液滴定,溶液变为淡紫色,消耗高锰酸钾溶液的体积为V1 mL。
Ⅲ.向上述溶液中加入足量Zn粉,使溶液中的Fe3+恰好全部还原为Fe2+。
Ⅳ.过滤,洗涤剩余的锌粉和锥形瓶,洗涤液并入滤液
Ⅴ.用c mol/L KMnO4溶液滴定该滤液至溶液出现淡紫色,消耗KMnO4溶液的体积V2 mL。
已知:2MnO4-+5H2C2O4+6H+=2Mn2+ +10CO2+8H2O
MnO4-+8H++5Fe2+=5Fe3+ + Mn2++4H2O
回答下列问题:
①若省略步骤Ⅳ,则测定的草酸根离子含量 (填“偏大”、“偏小”或“不变”)。
②m g样品中草酸根离子的物质的量为 (用c,V1,V2的式子表示,不必化简)。
氯气在工农业生产在应用非常广泛。下图是实验室制备氯气并进行一系列相关实验的装置。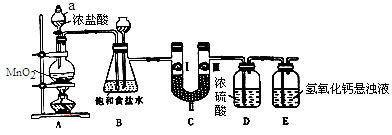
已知:MnO2+4HCl(浓)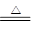 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)仪器a的名称为_______________。
(2)装置B中饱和食盐水的作用是______________________;装置B也作安全瓶,用来监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:_____________________。
(3)装置C的作用是验证氯气是否具有漂白性,为此装置C中I、II、III处依次放入______(填字母)。
| 选项 |
a |
b |
c |
| I |
湿润的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| II |
碱石灰 |
浓硫酸 |
无水氯化钙 |
| III |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(4)装置E中氢氧化钙悬浊液的作用是______________;请写出相应反应的离子方程式:_______________。
如图是产生和收集气体的实验装置,该装置最适合于( )
| A.用浓硝酸和Cu反应制取NO2 |
| B.用浓盐酸和MnO2反应制取Cl2 |
| C.用NH4Cl和Ca(OH)2反应制取NH3 |
| D.用H2O2溶液和MnO2反应制取O2 |
实验室制取少量干燥的氨气涉及下列装置,其中正确的是
| A.①是氨气发生装置 | B.③可用于氨气的发生装置 |
| C.②是氨气吸收装置 | D.④是氨气收集、检验装置 |
下列气体中能用排水法收集的无色气体是
| A.SO2 | B.Cl2 | C.NO2 | D.NO |
下图所示的实验操作,不能达到相应目的的是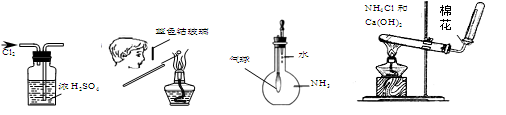
| A.干燥氯气 | B.检验K2CO3中K+ | C.证明NH3极易溶于水 | D.实验室制NH3 |
亚硝酸钠在漂白、电镀等方面应用广泛。现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如右图所示(部分夹持装置略)。已知: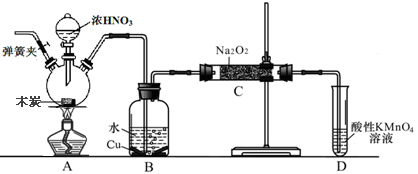
①3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O
②酸性条件下,NO与NO3-都能与MnO4-反应生成NO3-和Mn2+;
完成下列填空:
(1)写出a仪器的名称___________________________。
(2)为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为__________________。
(3)写出NO与Na2O2在常温下生成NaNO2的化学反应方程式______________________;当该反应中转移0.1mole-时,理论上吸收标准状况下NO的体积为__________L。
(4)将11.7g过氧化钠完全转化成亚硝酸钠,理论上至少需要木炭__________g。
(5)NO2易溶于水。将体积为V mL的试管充满NO2后倒扣在水中,见右图。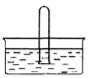
①NO2溶于水的化学方程式是_________________________。
②使试管中NO2完全被水吸收的操作是______________________________。
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
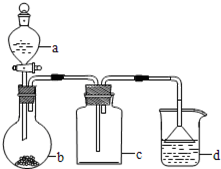
| 选项 |
a中的物质 |
b中的物质 |
c中的物质 |
d中的物质 |
| A |
浓氨水 |
CaO |
NH3 |
H2O |
| B |
浓硫酸 |
Na2SO3 |
SO2 |
NaOH溶液 |
| C |
稀硝酸 |
Cu |
NO2 |
H2O |
| D |
浓盐酸 |
MnO2 |
Cl2 |
NaOH溶液 |
某学习小组利用下图所示装置制备氨气,并探究氨气的性质(部分仪器略去)。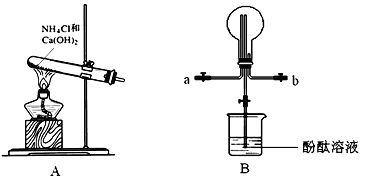
请回答下列问题:
(1)写出以A装置制备氨气的化学方程式:__________________
(2)用B装置收集氨气时,氨气的进气口是__________(填“a”或“b”)。
(3)B装置中烧瓶已收集满氨气,若要使之形成喷泉,操作方法是__________。若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是_________。
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是_________(填序号)。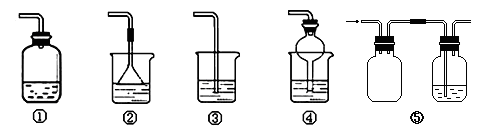
(5)氨气在催化剂并且加热时会被空气氧化,这是工业制硝酸的第一步反应,写出该反应的化学方程式:_________。
硅酸钠被国家列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一。下图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程示意简图:
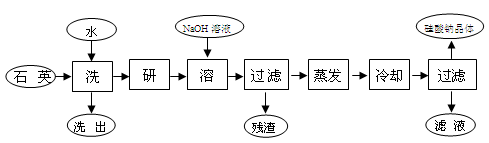
(1)要将洗出液中的溶质析出,采用的方法是 (填:“蒸发”、“降温”)结晶;蒸发时用到的硅酸盐仪器有 、 、 。
(2)上述流程中加入NaOH溶液,反应的离子方程式为 。
(3)用上述残渣中的氧化铁焊接铁轨,其铝热反应的化学方程式为(并在方程式中用“单线桥”标出电子转移方向和数目) 。
能选用右图装置正确完成的实验是
| A.用铅粒与稀硫酸制取并收集H2 |
| B.用少量MnO2和H2O2制取并收集O2 |
| C.用生石灰和浓氨水制取并收集NH3 |
| D.用浓硫酸和浓盐酸制取并收集HCl |
实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物呈棕红色,易潮解,100℃左右时会升华。如图是两个学生设计的实验装置,左边的反应装置相同,而右边的产品收集装置不同,分别如装置Ⅰ和装置II所示。已知B中反应的化学方程式为MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑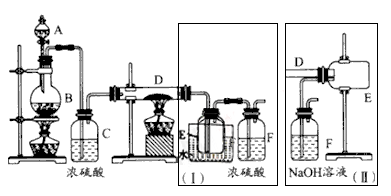
(1)C中浓硫酸的作用是___________________。
(2)D中的反应开始前,要先通入一段时间的氯气,其原因是____________________。
(3)D中反应的化学方程式为________________________。
(4)装置Ⅰ的主要缺点是____________________________。
(5)装置II的主要缺点是___________________________。