实验室用MnO2粉末与浓盐酸共热制取氯气:
MnO2+4HCl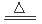 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
实验Ι 验证氯气能否与水反应
某同学设计了如下图所示的实验装置:
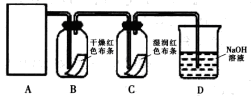
(1)从下图选择适合A处的装置__________(填序号)。
(2)装置B中能否观察到预期的实验现象?_________(填“能”或“不能”),请说明理由______________。
实验II 测定反应后A中残余盐酸的浓度
步骤一:配制100mL1.00mol∙L-1的NaOH溶液,配制过程如下:
①称量_______gNaOH固体,在烧杯中用适量蒸馏水溶解,冷却。
②将烧杯中的溶液转移至________中,并用少量蒸馏水洗涤烧杯内壁及玻璃棒2~3次,洗涤液也注入容量瓶中。
③继续加蒸馏水至离刻度线1~2cm处,改用_________滴加蒸馏水至凹槽面最低处与刻度线相切。
④盖上瓶塞,上下颠倒摇匀,将所配溶液转移至指定试剂瓶中,贴上标签。
步骤二:取2.00mL反应后A中的溶液,稀释后滴加步骤一配制所得NaOH溶液,恰好完全反应时,消耗NaOH溶液的体积为11.80mL。
(3)完成步骤一的空格。
(4)根据实验数据,计算反应后A中残余盐酸的浓度为_________mol∙L-1。
(5)某同学欲通过测Cl-浓度来推测反应后A中残余盐酸的浓度,取2.00mL反应后A中的溶液,加入2.00mol∙L-1AgNO3溶液至不再产生沉淀时,发现所加的AgNO3溶液的体积远大于理论值5.80mL,其原因是____________。
苯甲酸(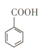 )和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率。据此某实验小组设计了如下图的装置来进行上述实验。相关信息如下:
)和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率。据此某实验小组设计了如下图的装置来进行上述实验。相关信息如下:
| |
相对分子质量 |
密度/(g·cm-3) |
沸点/℃ |
水中溶解度 |
| 苯甲酸 |
122 |
1.27 |
249 |
微溶 |
| 乙醇 |
46 |
0.789 |
78.3 |
易溶 |
| 苯甲酸乙酯 |
150 |
1.05 |
212.6 |
难溶 |
实验方案为:
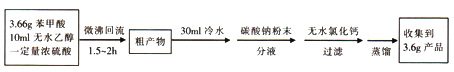

(1)仪器甲的名称为________________。
(2)①往丙中加入药品的顺序为_________________。
A.无水乙醇、浓硫酸、苯甲酸晶体 B.浓硫酸、苯甲酸晶体、无水乙醇
C.苯甲酸晶体、无水乙醇、浓硫酸 D.苯甲酸晶体、浓硫酸、无水乙醇
②若加热反应后发现未加沸石,应采取的正确操作是_____________。
③微沸回流过程中,可以看到乙内的混合试剂的颜色变为_______色。
(3)加入碳酸钠粉末的作用是__________________。
(4)分液要用到的玻璃仪器有__________,粗产物在_______层(填“上”或“下”)。
(5)加热蒸馏若采用下图装置(加热装置已经略去)进行,该装置存在的2个问题为__________、________。
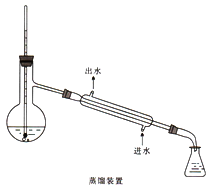
(6)本实验所得到的苯甲酸乙酯产率为______________。
(7)装置乙的作用为____________________
下列实验装置进行相应的实验,不能达到实验目的的是( )
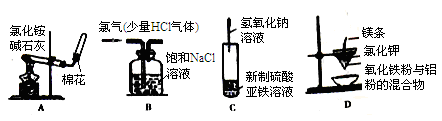
| A.实验室制取并收集氨气 | B.除去Cl2中的HCl气体杂质 |
| C.实验室制取氢氧化亚铁 | D.铝热反应实验 |
菠菜是一种富含草酸(乙二酸)的绿色蔬菜,但食用时要避免和豆腐同时食用,因为二者容易产生难溶于水的物质而在体内生成结石。草酸也是有机化工中的重要原料,广泛应用于化工生产中。为探究草酸的某些性质,某中学化学兴趣小组查阅了一些资料如下:
| 物质 |
结构 |
某些性质 |
| 草酸 |
分子式:H2C2O4·2H2O |
无色,易溶于水;其钠盐和钾盐易溶于水,钙盐难溶于水 |
| 结构简式:HOOC-COOH |
熔点:101℃;升华温度:125℃;170℃以上分解 |
回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。
装置C中可观察到的现象是①导管口有气泡出现 ②石灰水变浑浊,由此可知草酸晶体分解的产物有__________。装置B的主要作用是_______________。若无此装置C中可能发生的反应的化学方程式为___________________。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为了进行验证,选用甲组实验中的装置A、B和下图所示的部分装置进行实验。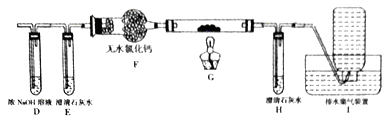
①乙组的实验装置中,装置E和H中的澄清石灰水的作用分别是_________和__________;装置G反应管中盛有的固体物质是___________;I中集气瓶收集到的气体主要是_______________。
②能证明草酸晶体分解产物中有CO的现象是____________________________。
下列的实验操作不能达到预期目的的是( )
①在苯酚溶液中滴入少量稀溴水出现白色沉淀
②配制银氨溶液时,将2%氨水慢慢滴入2%硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
③将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复原来的红色
④将苯和溴水混合后加入铁粉制取溴苯
⑤用乙醇和3%的硫酸共热到170℃制取乙烯
| A.①③④ | B.②③④ | C.①④⑤ | D.①②④⑤ |
利用废旧镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO,制备流程图如下:
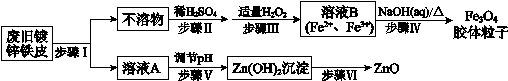
已知:Zn及其化合物的性质与Al及其化合物的性质相似。
回答下列问题:
(1)步骤I中所用的试剂是___________。
(2)步骤III中反应的离子方程式是__________________________________。
(3)步骤V可选用的试剂是_________(填序号)。
a.NaOH溶液 b.氨水 c.盐酸
(4)步骤VI的实验操作是_____________。
现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
已知反应I为:NaCl + CO2 + NH3 + H2O === NaHCO3↓+ NH4Cl
(1)工业生产中,制备NH3的化学方程式是_____________________________。
(2)海水中含有大量的NaCl,以及少量的Ca2+、Mg2+、SO42−等离子。
① 为得到纯净的饱和NaCl溶液,进行了如下操作。请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中___________________________,过滤;
c.向滤液中___________________________,过滤;
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液。
② 步骤c中反应的离子方程式是______________________________。
(3)反应II的化学方程式是_________________________________。
(4)制得的纯碱中含有少量NaCl。取5.5 g纯碱样品加入足量稀硫酸,得到标准状况下1120 mL CO2。则样品中纯碱的质量分数是_________%(保留1位小数)。
下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
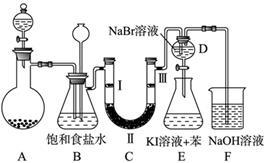
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为: 。装置B中饱和食盐水的作用是 ;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入 。
| |
a |
b |
c |
d |
| Ⅰ |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| Ⅱ |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| Ⅲ |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为 色,打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是 。
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的离子方程式: 。
(5)如果将过量二氧化锰与20 mL 12 mol·L-1的浓盐酸混合加热,充分反应后生成的氯气0.06mol。(填“大于”“小于”“等于”),若有17.4g的MnO2被还原,则被氧化的HCl的质量为 。
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
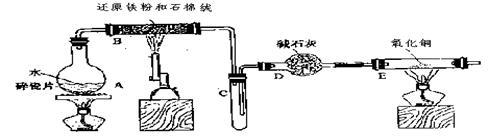
(1) 烧瓶底部放置了几片碎瓷片,
碎瓷片的作用是 。
装置B中发生反应的化学方程式是____________________________ ____。
(2)如果要在C处玻璃管处点燃该气体,则必须对该气体进行 ,装置E中的现象是_ 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。
简述检验滤液中Fe3+的操作方法____________________________。
(4) 该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
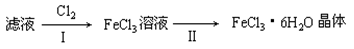
步骤I中通入Cl2的作用是________________________________。
下列气体可用排水法收集的是
| A.NH3 | B.NO2 | C.NO | D.SO2 |
工业上用软锰矿(主要成分MnO2,杂质金属元素Fe、Al等) 制备MnSO4·H2O 的一种工艺流程如下:
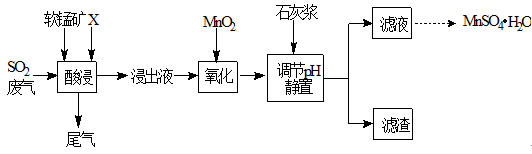
已知:
1.浸出过程中发生的主要反应化学方程式为:MnO2+SO2 =MnSO4
2.浸出液中阳离子主要有Mn2+、Fe2+、Al3+等
回答下列问题:
(1)物质X最好选用
a.盐酸 b.硫酸 c.硝酸
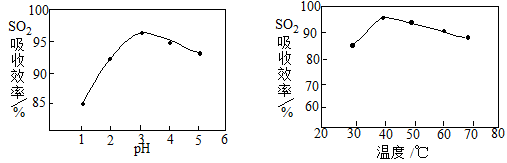
(2)酸浸时SO2的吸收效率与pH、温度的关系如下图所示,为提高SO2的吸收效率,酸浸适宜的条件是 。
(3) 流程中“氧化”步骤主要反应的离子方程式是 。
(4) 加入石灰浆调节pH,可将氧化后的浸出液中Fe3+、Al3+形成氢氧化物除去。检验Fe3+是否除尽的最佳方法是 。
(5) 用MnSO4可测定水中溶解氧,方法是:取100 mL 水样,迅速加入足量MnSO4溶液及含有NaOH的KI溶液,立即塞上塞子、振荡,使之充分反应;打开塞子,迅速加入适量的稀硫酸,此时有I2生成;再用5.00×10-3 mol·L-1 Na2S2O3溶液和I2反应,当消耗Na2S2O3溶液 12.0 mL时反应完全。有关化学反应方程式如下:
① 2Mn2++O2+4OH-=2MnO(OH)2(反应很快);
② MnO(OH)2+2I-+4H+=Mn2++I2+3H2O;
③ I2+2S2O32-=S4O62-+2I-。
计算水样中溶解氧的浓度(以mg·L-1为单位),写出计算过程。
下列气体不能用排空气法收集的是
| A.NO | B.NO2 | C.SO2 | D.NH3 |
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用图9所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。请填写下列空白:
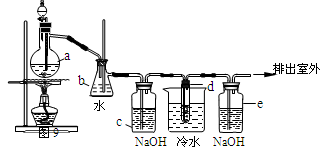
(1)烧瓶a要求温度迅速升高到170℃发生反应,写出该反应的化学方程式 ;该反应类型为 。
(2)写出制备1,2-二溴乙烷的化学方程式 。
(3)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象 。
(4)容器c中NaOH溶液的作用是 ;e装置内NaOH溶液的作用是 。
(5)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因(至少2点) 、 。
下图是实验室制取乙炔气体及乙炔的性质实验的装置,气密性已检验,部分夹持装置略。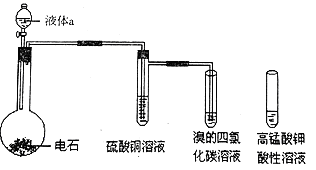
(1)实验室制取乙炔时,分液漏斗中的液体a通常是__________________________;
(2)圆底烧瓶中生成乙炔的化学方程式是__________________________;
(3)硫酸铜溶液的作用是____________________________;
(4)将通过硫酸铜溶液的气体通入溴的四氯化碳溶液中,反应的方程式是_______________;
若改为通入酸性高锰酸钾溶液中,现象是__________________________________;
(5)乙炔与氯化氢加成可以生成氯乙烯聚合生成聚氯乙烯的方程式是__________________。