(1)(NH4)2SO4在强热条件下,可分解生成NH3、SO2、N2、H2O.
反应中氧化产物和还原产物的物质的量之比为 。
(2)将K2S跟HNO3反应,生成NO、S、KNO3、H2O,反应的化学方程式为 ;氧化产物是 ; 若生成2molNO,反应中电子转移的总物质的量为 mol。
根据反应(1)2P+5Br2+8H2O=2H3PO4+10HBr
(2)Cl2+2HBr=2HCl+Br2
(3)2KMn04+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
推断氧化性(氧化剂)由强到弱的顺序是 。
还原性(还原剂)由强到弱的顺序是 。
下列反应能说明卤素非金属性活泼顺序是Cl>Br>I的是 ( )
①2HClO4+Br2(气) = 2HBrO4+Cl2 ②2NaBr+Cl2= 2NaCl+Br2
③2KI+Cl2= 2KCl+I2 ④2KI+Br2= 2KBr+I2
| A.①②③ | B.①②④ | C.②③④ | D.①②③④ |
已知反应①2BrO3- + Cl2 =Br2 +2ClO3-②5Cl2 + I2 +6H2O=2HIO3 +10HCl
③ClO3- +5Cl-+6H+=3Cl2 +3H2O,下列物质氧化能力强弱顺序正确的是( )
| A.ClO3->BrO3->IO3->Cl2 | B.BrO3->Cl2>C1O3->IO3- |
| C.BrO3->ClO3->Cl2>IO3- | D.Cl2>BrO3->C1O3->IO3- |
向NaBr、NaI、Na2SO3混合液中,通入—定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是 ( )
| A.NaCl Na2SO4 | B.NaCl NaBr Na2SO4 |
| C.NaCl Na2SO4 I2 | D.NaCl NaI Na2SO4 |
(1)配平氧化还原反应方程式: C2O42-+ MnO4-+ H+= CO2+ Mn2++ H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为 mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由 变为 。该溶液中还原剂的物质的量为 mol。
工业上从硒的废料中提取硒的方法之一是用H2SO4和NaNO3处理废料,获得亚硒酸和少量硒酸。加入盐酸共热,硒酸被转化为亚硒酸(2HCl+H2SeO4==H2SeO3+Cl2+H2O),再将SO2通入亚硒酸溶液中,单质硒即析出。下列叙述正确的是 ( )
| A.H2SeO4的氧化性强于于Cl2 | B.亚硒酸氧化性强于亚硫酸 |
| C.亚硒酸的还原性强于亚硫酸 | D.析出1molSe需H2SeO3、SO2、H2O各1mol |
已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是( )
A.上述实验证明氧化性:MnO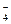 >Cl2>Fe3+>I2 >Cl2>Fe3+>I2 |
| B.实验①证明Cl—被还原 |
| C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝 |
| D.实验③中氧化剂与还原剂的物质的量之比为2:1 |
根据反应(1)~(4),可以判断下列四种物质的氧化性由强到弱的正确顺序
(1)Cl2+2KI===2KCl+I2 (2)2FeCl2+Cl2===2FeCl3
(3)2FeCl3+2HI===2FeCl2+2HCl+I2 (4)H2S+I2=2HI+S
| A.H2S>I2>Fe3+>Cl2 | B.Cl2>Fe3+>I2>H2S |
| C.Fe3+>Cl2>H2S>I2 | D.Cl2>I2>Fe3+>H2S |
根据下列三个反应的化学方程式,下列关系式正确的是( )
① I2+SO2+2H2O=H2SO4+2HI ② 2FeCl3+2HI=2FeCl2+2HCl+I2 ③ 2FeCl2+Cl2=2FeCl3
| A.氧化性:Fe3+>Cl2>H2SO4>I2 | B.还原性:SO2>I->Fe2+>Cl- |
| C.Fe与I2化合:2Fe+3I2 =2FeI3 | |
| D.FeI2溶液中通入少量的Cl2:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
已知重铬酸钾(K2Cr2O7)是一种中学化学常用的强氧化剂,重铬酸钾溶液中存在如下平衡:
H+(aq)+ CrO42-(aq)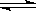 Cr2O72-(aq)+H2O。若要使溶液的橙色加深,下列可采用的方法是:
Cr2O72-(aq)+H2O。若要使溶液的橙色加深,下列可采用的方法是:
| A.加入适量稀盐酸 | B.加入适量稀硝酸 | C.加入适量烧碱固体 | D.加水稀释 |
根据以下实验事实,判断四种粒子在酸性条件下,氧化由强到弱的顺序是 ( )
①向FeCl3溶液中滴加KI溶液,再加入CCl4,振荡,CCl4层呈紫红色
②向FeCl2溶液中加入氯水,再加入KSCN溶液,呈红色
③向KMnO4溶液中加入浓盐酸,振荡后紫色褪去
| A.I2>Cl2>Fe3+>MnO4- | B.MnO4->Cl2>Fe3+>I2 |
| C.Cl2>I2>Fe3+>MnO4- | D.Fe3+>MnO4->Cl2>I2 |
已知非金属单质A2、B2、C2之间能发生如下反应:A2+2B-=2A-+B2, B2+2C-=2B-+C2.以下说法正确的是 ( )
| A.氧化性:A2>B2>C2 | B.还原性:A->B->C- |
| C.单质活动性:C2>B2>A2 | D.反应:A2+2C-=2A-+C2不能发生 |
在一种酸性溶液中存在NO3-、I-、CI-、Fe3+中一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推断溶液中( )
①一定含有I-,不能确定是否有CI- ②一定含有NO3-
③不含有Fe3+ ④一定含有I-、NO3-和CI-
| A.① | B.②③ | C.④ | D.①③ |