几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
X |
Y |
Z |
W |
| 原子半径/pm |
160 |
143 |
70 |
66 |
| 主要化合价 |
+2 |
+3 |
+3、+5、-3 |
-2 |
下列叙述正确的是
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z从其氢化物中置换出来
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是
| A.化合物YX、ZX2、WX3都是酸性氧化物 |
| B.元素W 的最高价氧化物对应水化物的酸性比Z 的弱 |
| C.原子半径的大小顺序: rY >rZ >rW >rX |
| D.元素X 的简单气态氢化物的热稳定性比W 的弱 |
M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
(1)元素Q的名称为____________,P的基态原子价层电子排布式为____________。
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低,是因为______________。
(3)M、O电负性大小顺序是__________(用元素符号表示),O的最高价含氧酸根的空间构型为__________,其中心原子的杂化类型为__________。
(4)M、N形成的化合物的晶胞如图所示,该晶胞的化学式为__________,其中M离子的配位数为__________,该晶体类型为______________。
(5)该晶胞的边长为a×10-10cm,则距离最近的M、N离子间的距离为__________ 。
氨和水都是常用的试剂。请回答下列问题:
(1)氮元素在元素周期表中的位置是 ;基态氮原子的核外电子中,未成对电子数与成对电子数之比为____________。
(2)NH3分子可结合一个H+形成铵根离子(NH)。
①NH3分子中N原子的杂化类型是____________。
②NH3分子与H+结合的过程中未发生改变的是____________(填选项字母)。
A.微粒的空间结构 B.N原子的杂化类型 C.H—N—H的键角
(3)将氨气通入CuSO4溶液中,产生蓝色沉淀,继续通过量氨气,沉淀溶解,得到蓝色透明溶液。[Cu(H2O)6]2+(水合铜离子)和[Cu(NH3)4]2+中共同含有的化学键类型是 。生成蓝色沉淀的离子方程式是 。
根据电子排布的特点,Cu在周期表属于
| A.s区 | B.p区 | C.d 区 | D.ds区 |
合成尿素的反应为: 完成下列填空:
完成下列填空:
(1)写出NH3的电子式 ;画出碳原子结构示意图 ;氧元素位于周期表第 周期第 族。
(2)上述反应所涉及的4种元素,原子半径从大到小的排列顺序为 。
(3)上述反应所涉及的4种元素中,非金属性最强的是 。
(4)一定条件下,在10L的恒容密闭容器中,充入2mol NH3和1mol CO2,反应经5min后达到平衡,测得容器中水蒸气0.6mol,则平均反应速率v(NH3)= mol/(L·min)。
(5)下列能说明上述反应己达平衡的是 。(填序号)
a.2c(NH3)=c(H2O) b.CO2的浓度不变
c.v正(NH3):v正(CO2)=2:1 d.气体的压强不变
(6)为提高氨气的转化率,工业上用该反应生产尿素时,合适的反应条件是 。(填序号)
a.200℃ b.800℃ c.101kPa d.24000kPa
下列情况中不能说明X的非金属性比Y强的是
| A.同主族时X原子的电子层数比Y原子的电子层数少 |
B.X2+H2 2HX ,Y2+H2 2HX ,Y2+H2 2HY 2HY |
| C.气态氢化物水溶液的酸性X比Y强 |
| D.X的单质能将Y从NaY溶液中置换出来 |
原子结构为 的元素,位于元素周期表的
的元素,位于元素周期表的
| A.第六周期第IV族 | B.第四周期第VI族 |
| C.第六周期第A族 | D.第四周期第VIA族 |
有A、B、C、D四种元素的离子A+、B2+、C- 、D2-,它们具有相同的电子数,下列判断中,正确的是
A.A、B、C、D四种元素可能属于同一周期
B.A、B、C、D四种元素一定属于短周期元素
C.原子序数由大到小的顺序是B>A>C>D
D.离子半径由大到小的顺序是、B2+>A+>C- >D2-
关于氟、钠、镁、氯四种元素的性质递变规律,描述正确的是
| A.原子半径:Na<Cl | B.热稳定性:HCl<HF |
| C.离子半径:F-<Mg2+ | D.碱性:NaOH<Mg(OH)2 |
下列各组微粒中,互为同素异形体的是
| A.H和D | B.O2和O3 |
| C.CH3CH2CH2CH3和(CH3)3CH | D.H2O和D2O |
下列说法正确的是
| A.石油裂解、煤的气化、海水制镁等过程中都包含化学变化 |
| B.通过化学变化可以实现235U与238U的相互转化 |
| C.煤经气化、液化和干馏三个物理变化过程,可变为清洁能源 |
| D.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
利用周期表中同族元素的相似性,可预测元素的性质。
(1)P元素的基态原子有_______个未成对电子,白磷的分子式为P4,其结构如下图所示。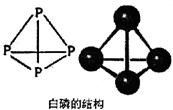
科学家目前合成了N4分子,N原子的杂化轨道类型是________,N -N键的键角为________;N4分解后能产生N2并释放出大量能量,推测其用途为________。
(2) N、P、As原子的第一电离能由大到小的顺序为________。
(3)立方氮化硼晶体的结构如下图所示:
该晶体中,B原子填充在N原子的________空隙,且占据此类空隙的比例为________ (填百分数)。
(4) N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是________;立方砷化镓晶体的晶胞边长为a pm,则其密度为________g·cm-3 (用含a的式子表示,设NA为阿伏加德罗常数的值)。