阅读材料,回答问题。
材料I 氯气(Cl2)在通常情况下为黄绿色有毒气体。
材料Ⅱ Cl2化学性质很活泼,具有较强的氧化性,能与多种金属和非金属直接化合。氢气和氯气的混合气点燃或强光照射时发生爆炸。
材料Ⅲ Cl2可用于制备多种消毒剂,含氯元素的消毒剂有ClO2、NaClO、Ca(ClO)2等。
(1)实验室闻氯气的正确操作是 。
(2)氢气和氯气生成氯化氢气体的反应从能量变化(“吸热反应”或“放热反应”)和基本反应类型角度分类,分别属于 、 。
(3)下列说法错误的是 (选填字母序号)
A燃烧一定包含着化学变化
B燃烧不一定要有氧气参加
C物质与氧气发生的反应都属于氧化反应
D爆炸一定是可燃物与氧气发生的发光、放热的剧烈的氧化反应
小明向氢氧化钠溶液中滴加稀盐酸,发现没有明显现象.为了判断两者是否恰好完全反应,他取少量反应后的溶液加入试管中,滴加几滴无色酚酞试液,振荡后观察到酚酞试液不变色.
(1)根据上述现象,小明得出“两种物质恰好完全反应”的结论.小白认为小明的结论是不合理的,其理由是________.
(2)小白利用pH试纸测反应后溶液的pH,以确定两者是否恰好完全反应.请你选用其他试剂再设计一个实验,以验证氢氧化钠和盐酸是否恰好完全反应(要求写出选用的试剂、可能观察到的现象和相应的结论)________.
(3)小白为了继续探究“在氢氧化钠与盐酸反应的过程中,溶液的pH是如何变化的”这一问题,进行如下实验:在一定量的氢氧化钠溶液中逐渐滴加盐酸,用pH试纸测定溶液的pH,记录数据如下表:
| 盐酸的体体/mL |
0 |
10 |
19.5 |
20 |
20.5 |
30 |
40 |
| pH |
13 |
12 |
10 |
7 |
3 |
2 |
1 |
下图中能合理表示该反应过程中溶液pH变化的是________.
在2014年索契冬季奥运会上,中国运动员共
获得了九枚奖牌,成为亚洲体坛霸主。
⑴图1是速度滑冰运动员使用的刀冰鞋。
①刀冰鞋中含有的金属单质是 (写化学式), 属于有机合成材料的是 。
②制造刀冰鞋的铝合金材料具有较好的抗腐蚀性,请用化学方程式表示铝具有较好的抗腐蚀性的原因 。
⑵图2是2014年索契冬奥会的火炬,火炬外形像神话传说中的火鸟。采集圣火,在太阳光下将火炬燃料喷口伸向凹面镜焦点位置,打开阀门,火炬将被点燃。火炬能被点燃的原因是 。火炬传递结束后,采用关闭燃气阀门的方法熄灭火炬,其中蕴含的灭火原理是 。
下列方法可以解决生活中的一些问题:
(1)在河道上设置拦污网拦截漂浮垃圾,是应用了 操作。
(2)生石灰常用作食品干燥剂,它起干燥作用时发生反应的化学方程式是 。
(3)服用含碳酸氢钠的药物可以治疗胃酸过多症,反应的化学方程式是 。
图示是某化学反应的微观示意图.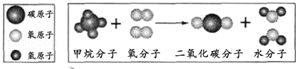
(1)根据图示,请从微观角度描述你获得的关于化学变化的一个信息.
(2)写出该反应的化学方程式.
下表是KNO3、NaCl在不同温度下的溶解度(单位:g).
| 温度(℃) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
| KNO3 |
13.3 |
20.9 |
32 |
45.8 |
64 |
85.5 |
110 |
138 |
169 |
202 |
246 |
| NaCl |
35.7 |
35.8 |
36 |
36.3 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
39 |
39.8 |
(1)以上两物质溶解度的变化受温度影响较小的是________.
(2)30℃时,KNO3的溶解度是________g.
(3)KNO3溶液中含有少量NaCl时,可通过________的方法提纯.
(4)对(3)析出的晶体和剩余溶液描述正确的是________(填写编号).
Ⅰ.剩余溶液一定是KNO3的饱和溶液
Ⅱ.剩余溶液一定是NaCl的不饱和溶液
Ⅲ.上述方法可以将两者完全分离
Ⅳ.析出的晶体中只含有KNO3
(5)在一定温度下,将含69g KNO3、18g NaCl的混合物完全溶解在50g水中.改变温度使KNO3析出,NaCl不析出,则温度T(℃)的范围是________(硝酸钾和氯化钠溶解度互不影响).
在宏观、微观、符号之间建立联系,是化学学科特有的思维方式。
(1)樟脑是一种白色晶体,可以散发出特殊气味,使衣物免受虫蛀。樟脑的化学式为C10H16O,樟脑的组成元素有 种,其中氢元素和氧元素的质量比为 。
(2)可溶性酸、碱、盐在水中可解离出阴阳离子,我们现阶段所学的复分解反应的实质就是酸、碱、盐解离出的一些阴、阳离子相互结合生成难解离的水、气体或沉淀,根据下列溶解性表及氢氧化钠溶液和盐酸反应的微观示意图回答问题。

部分碱和盐的溶解性表(20 ℃)
|
Na+ |
K+ |
Ba2+ |
||||
| OH– |
溶 |
溶 |
溶 |
||||
| SO42- |
溶 |
溶 |
不 |
||||
| CO32- |
溶 |
溶 |
不 |
①如上图所示,HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推H2SO4在水中会解离出的离子是 (填离子符号)。
②根据上述微观示意图写出化学方程式 ,判断反应前后溶液中数目发生变化的粒子是
(填粒子符号)。
③根据溶解性表及复分解反应的实质判断,将“硫酸、氯化钡、氢氧化钠、碳酸钾”四种物质的溶液两两混合,能发生的反应有 个。
根据下列化合物与单质相互转化的关系,回答:
(1)若乙的溶液为浅绿色,Y是红色固体,则X是_____。
可能的化学方程式为________________________________________.
(2)若在常温下乙是气体,则X是__________。
下图是有关氧气的知识网络图(部分反应条件已略去)。
根据上图回答下列问题:
(1)生成氧气的两个反应都属于________反应(填基本反应类型),从节能、环保的角度
考虑,实验室制取氧气最好选用_________________作反应物。
(2)X的化学式为 ;若反应①在氧气充足的条件下进行,生成X的化学式
为 。
(3)若反应②的化学方程式为Y+5O2点燃 3CO2+4H2O,Y的化学式为 。
(4)写出反应③的化学方程式______________________________。
(5)在做反应④实验时,要预先在盛放氧气的集气瓶中放______________________。
人类的生产生活离不开金属,下列三种金属使用的先后顺序依次为:铜、铁、铝.
(1)金属被使用的先后顺序跟________(填序号)选项关系最大.
①地壳中金属元素的含量;②金属的导电性;③金属的活动性.
(2)为探究锰与铁的金属活动性,在相同温度下,取大小相同、表面光亮的两种金属薄片,分别投入等体积、等溶质的质量分数的足量稀盐酸中(反应后Mn显+2价),请回答:
| 金属 |
铁 |
锰 |
| 与稀盐酸反应现象 |
放出气泡速率缓慢 |
放出气泡速率较快 |
| 结论 |
活动性铁________锰(填“>”或“<”) |
除了比较与酸反应产生气体速率的快慢,请你再举出一种可比较这两种金属活动性强弱的方法(写出所需药品即可):________________________________________________.
(3)将一定量的铝加入到硫酸亚铁和硫酸铜的混合溶液中,充分反应后过滤,向滤渣中加入盐酸,有气泡产生.则滤渣中一定有的物质是________________.(填化学式)
阅读下列科技短文并回答问题。
过氧化氢可用于消毒杀菌,具有不稳定性。将水蒸气冷凝在硅、玻璃、塑料、金属等材料表面,均发现了过氧化氢的存在。
研究显示:水蒸气冷凝为粒径小于10微米的液滴时,部分水分子会转化为过氧化氢分子。水微滴中形成的过氧化氢含量随液滴尺寸的增大而减少。过氧化氢的产生量与湿度、温度等环境条件密切相关。当使用硅材料、相对湿度为55%时,得到过氧化氢的最大浓度随温度变化关系如图所示。

(1)文中涉及到的有机合成材料是_____。
(2)过氧化氢不稳定的原因是_____(用化学方程式表示)。
(3)下列说法错误的是_____(填字母序号)。
| A. | 水蒸气在冷凝过程中可能发生化学变化 |
| B. | 水蒸气在玻璃表面冷凝得到的液滴一定为纯净物 |
| C. | 一定条件下,水蒸气冷凝可用于材料表面的绿色消毒 |
| D. | 水蒸气冷凝为水滴时,水分子间的间隔减小 |
(4)如图中a点( )未生成过氧化氢的原因可能是_____。
钛和钛合金被认为是21世纪的重要金属材料,他们具有很多优良的性能,如熔点高,密度小,可塑性好等。以钛铁矿(主要成分为FeTiO 3,同时含有少量的Fe 2O 3、FeO等)为原料制TiO 2,再由TiO 2制金属Ti的工艺流程如图:

【查阅资料】钛、镁在高温下与空气中的氧气、二氧化碳等反应。
(1)写出工艺流程中生成硫酸铁的化学方程式 ,该反应的基本类型是 反应。
(2)操作2的名称是 。
(3)工艺流程中,水解属于 变化。
(4)工业上常在高温和氩气氛围中,用金属镁和TiCl 4反应的方法制备Ti,氩气的作用是 。
(5)TiO 2可与焦炭、氯气在高温下反应,该反应中氯气和碳的质量按71:12的比例参加反应,反应的化学方程式为 。
在化学反应中,凡是元素化合价发生改变的反应,称为氧化还原反应。配平这类化学方程式往往采用"化合价升降法"更方便快捷,即反应中元素"化合价升高总数=化合价降低总数"
例如:
具体配平步骤如下:
①"标变价":找出化合价发生改变的元素,并标出改变前后的化合价。
②"列变化":列出改变的价态数。
升高3价 降低4价
③"找倍数":找出化合价升、降的最小公倍数
,从而确定
、
的系数。
④"配系数":再用观察法,配平其它系数。
根据以上信息,结合已学知识,回答下列问题:
(1)
中
元素的化合价为价,
中
元素的化合价为价。
(2)请配平下列化学方程式,(系数写在方框里,所有系数必须填写)
隔夜菜是否能吃,主要在于烧熟后的隔夜菜中亚硝酸盐的含量是否符合食品安全要求.蔬菜中的硝酸盐来自生长过程中所施氮肥.空气中的微生物(如硝酸盐还原菌)进入到蔬菜中.会产生一种还原酶,将蔬菜中的部分硝酸盐还原成亚硝酸盐.烧熟后的菜在食用和保存阶段都会有一些细菌进入;做熟的蔬菜更适合细菌生长.
某研究小组对烧熟的菜中亚硝酸盐含量做了测试,下表为盖有保鲜膜的菜肴在4℃的冰箱中放置不同时间的亚硝酸盐含量(单位:mg/kg).
| 菜肴 |
半小时 |
6小时 |
18小时 |
24小时 |
| 炒青菜 |
0.6861 |
0.7982 |
4.3333 |
5.3624 |
| 韭菜炒蛋 |
1.8153 |
1.9249 |
2.8390 |
5.6306 |
| 红烧肉 |
2.4956 |
4.2558 |
4.3668 |
5.5188 |
| 红烧鲫鱼 |
|
2.0948 |
3.2300 |
7.2397 |
将一份红烧鲫鱼样本(不盖保鲜膜)在常温下放置4小时,测定其亚硝酸盐含量为8.9483mg/kg.
请根据以上材料,回答下列问题:
(1)亚硝酸盐中含有 ,其中氮元素的化合价是________价.
,其中氮元素的化合价是________价.
(2)根据表中的数据,菜中的亚硝酸盐含量变化的共同规律是________________________________.
(3)要使烧熟后的隔夜菜中亚硝酸盐含量尽可能低,保存的条件应该是________________________.
(4)炒菜过程中温度一般在100℃以上,你认为从生菜炒到熟菜过程中的亚硝酸盐含量是否会持续增加________,原因是________________________.