我国古代科技璀璨夺目,金属的冶炼与使用在当时已处于世界先进水平。
(1)日常生活中,适合制作电缆的金属是______(填标号)。
| A. |
金 |
B. |
铜 |
C. |
汞 |
D. |
钨 |
(2)明代《天工开物》描述了锡的冶炼方法,如图a。
①原料锡砂中的 和木炭反应得到锡和二氧化碳,化学方程式为______。
②炼锡时混入少许铅形成合金,产物更易熔化流出,原因是______。
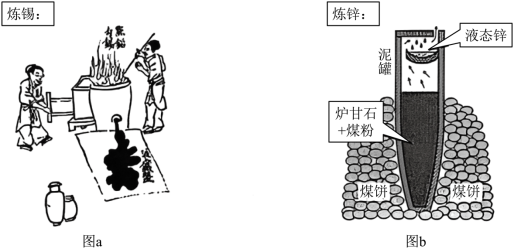
(3)图b为古代炼锌工艺原理示意图。炉甘石成分是 ,高温易分解生成 。
①泥罐外煤饼的主要作用是燃烧提供热量,泥罐内煤粉的主要作用是______。
②已知锌的沸点为 。泥罐下部温度可达 ,上部约为 ,该工艺从反应混合物中收集液态锌的方法属于______(填标号)。
| A. |
结晶 |
B. |
蒸发 |
C. |
蒸馏 |
D. |
升华 |
③必须冷却后才能取锌,是为了防止发生反应:______(写化学方程式)。
(4)湿法冶金利用置换反应。向 混合液中加入 粉,充分反应后过滤。若滤渣中有两种金属,则滤液中一定不含的金属阳离子是______。
某同学以金泥(含有 等)为原料制备( )和 的流程如图所示:
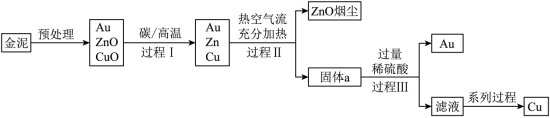
琴琴同学查阅资料已知:
①预处理的主要目的是将含硫化合物转化为氧化物。
②热空气流充分加热的目的是将 转化为氧化物,并完全分离出 烟尘。
(1)“预处理”中会产生 ,若 直接排放会导致______。
(2)“过程Ⅱ”产生的固体 中,除 外一定还有的物质是______。
(3)“过程Ⅲ”分离 的操作是______,加入过量稀硫酸的目的是______。
(4)“系列进程”中有一步是向滤液中加入过量铁粉,这一步生成气体的化学方程式为______,该反应属于______反应(填写基本反应类型)。
(5) 烟尘可用 溶液吸收,该反应生成偏锌酸钠( )和 的化学方程式为______。
已知H2与菱铁矿(主要成分 其他成分不参与反应)反应制成纳米铁粉。某小组进行探究并完成如下实验:
查阅资料:① 能与 反应生成 , 能使无水硫酸铜变蓝
② 与无水硫酸铜不反应
(1)某同学探究反应后气体成分,先将反应后气体通入无水硫酸铜,无水硫酸铜变蓝,证明气体中含有______,再通入足量的澄清石灰水,澄清石灰水变浑浊,反应方程式为______。
(2)对剩余气体成分进行以下猜想:
猜想一: 猜想二:______ 猜想三: 和
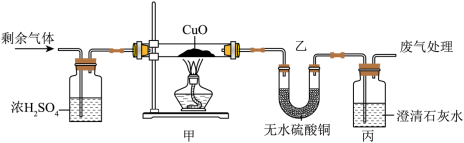
浓H2SO4的作用:______。
|
甲中现象:______。 乙中无水 变蓝 丙中变浑浊 |
猜想______正确 |
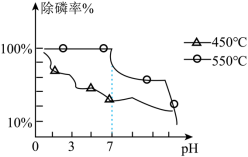
(3)热处理后的纳米铁粉能够除去地下水中的磷元素,如图所示 或者 热处理纳米铁粉的除零率以及 值如图所示,分析______ 时以及______(酸性或碱性)处理效果更好。
实验室现有 ,块状大理石,稀盐酸,棉花
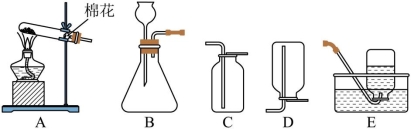
(1)亮亮根据现有药品制取氧气,方程式为______。制取一瓶较干燥的 应选择的发生装置和收集装置是______。(标号)
(2)根据现有药品选用______和稀盐酸反应制取 ,化学方程式为______。
(3)实验废液不能直接倒入下水道,取少量制备 后的废液于试管中,加入滴______(选填“紫色石蕊溶液”或“无色酚酞溶液”),溶液变红,则溶液显酸性。
中华人民共和国国家标准(GB2760﹣2011)规定葡萄酒中 最大使用量为0.25g/L。某综合实践活动小组测定葡萄酒中 的含量,取320mL某葡萄酒(加适量稀酸),加热使 全部逸出,并将 通入足量的 溶液中发生化合反应,待完全反应后,得到含溶质质量分数为0.098%的硫酸溶液100g。请回答下列问题:
(1)从上述信息可知:当压强一定时,升高温度, 气体在水中的溶解度 。(选填“增大”、“减小”或“不变”)
(2)通过计算判断该葡萄酒中 的含量是否符合国家标准?(写出计算过程)
绵阳西北部山区石灰石资源非常丰富,大量用于生产水泥。用石灰石和砂岩黏土高温煅烧得到一种新型水泥熟料,主要反应为: 。
(1)上述反应涉及四类化合物中的哪几类? 。
(2) 的化学式可表示为 ,含 44.8%的水泥熟料中含 的质量分数为 。
(3)在实验室用如图所示方法粗略测定石灰石中 的质量分数,无需测定的数据是 (填序号)。
| A. |
取用石灰石样品的质量 |
| B. |
倒入的过量稀盐酸的质量 |
| C. |
盐酸接触样品前电子秤的读数 |
| D. |
反应停止后电子秤的读数 |
(4)用含 90%的石灰石1000t生产新型水泥熟料,理论上会排放 多少吨?(无计算过程不给分)

工业上用 溶液蚀刻铜箔制造印刷电路板,反应为 ,蚀刻废液又可再处理,实现资源回收和循环利用,其流程转化关系如图。
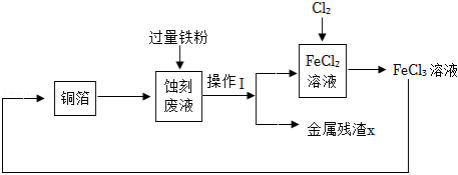
请回答相关问题。
(1)“蚀刻废液”的全部溶质有 和少量 。操作Ⅰ的名称是 。
(2)参照上述流程,画出由“金属残渣X”分离回收 和 溶液的简单流程图。
(3)上述流程中,能使三价铁转化为二价铁的物质有 。
(4)蚀刻掉128g铜,消耗 的质量为 g,理论上至少需要20% 溶液的质量为 g。(不需要写出计算过程)
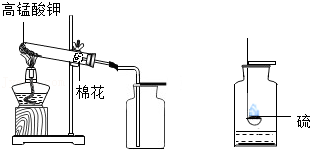
如图是氧气的实验室制取与性质实验。
(1)试管口棉花的作用是 。
(2)检验氧气集满的方法是 。
(3)制取氧气的主要步骤如下,正确的顺序是 (填序号)。
①装入药品,开始加热
②停止加热
③收集气体
④组装仪器,检查气密性
(4)硫在氧气中燃烧的现象是 。
(5)根据化学方程式计算,制取0.96g氧气,至少需要高锰酸钾的质量是多少?
高速钢是制造冰鞋冰刀的重要材料,其性能与含碳量关系密切。为测试冰刀中碳元素的质量分数,现取一定质量的冰刀于烧杯中,分3次每次加入100g溶质质量分数相同的稀硫酸,实验过程和数据如图所示。请根据相关信息回答下列问题。

(1)推算图中m的数值为 。
(2)请写出第2次反应后溶液中溶质的化学式 。
(3)计算冰刀中碳元素的质量分数(不考虑杂质,结果精确到0.01%)。
请阅读下面的材料,回答有关问题。
研究显示:每年排放的二氧化碳近一半存留在大气层,其它被陆地和海洋吸收。人类大量使用煤、石油和天然气等化石燃料,砍伐森林,导致过量的二氧化碳进入海洋,使海洋酸化,表层海水平均pH从8.1下降到7.9。人类给海洋的二氧化碳越多,海水pH越小,吸收二氧化碳的能力就会相对减弱,这样的循环会导致海洋生物链发生变化。
垃圾焚烧发电是生活垃圾处理的有效方式之一,但垃圾焚烧会产生烟尘和有害气体,还会增加二氧化碳的排放,加剧海洋酸化;同时垃圾焚烧需要购买辅助燃料,成本较高。我国烟气处理协同P2G技术很好地解决了这些问题,其主要流程如图所示。

(1)过量的二氧化碳进入海洋,使海洋酸化,发生反应的化学方程式为 。
(2)下列有关海洋酸化的说法不正确的是 (选填字母序号)。
| A. |
海洋酸化是指表层海水呈酸性 |
| B. |
海洋酸化会导致气候变暖加剧 |
| C. |
海洋酸化不会影响海洋生物及其生态系统 |
| D. |
海洋酸化会改变海水中某些离子的浓度 |
(3)流程中“净化装置”的作用是 ,“其它气体”的主要成分有O2和 (填化学式)等气体。
(4)使用P2G技术的优点是 (写一条即可)。
(5)“甲烷化装置”中发生的化学反应是 ,其中X是 (填化学式)。
(6)若用P2G技术处理550kg二氧化碳,使其完全反应。请根据化学方程式计算生成甲烷的质量(写出计算过程)。
(1)某化学小组的同学对金属元素及金属材料进行系列研究。
①人类文明进步与金属材料的发展关系十分密切。常见的金属材料有铁合金、铜合金、铝合金,这三种合金被广泛应用的年代由远及近的正确排列顺序是下列选项中的 (填选项序号之一)。
| A. |
铜合金→铁合金→铝合金 |
| B. |
铁合金→铝合金→铜合金 |
| C. |
铝合金→铜合金→铁合金 |
②我国劳动人民很早就掌握了湿法冶金的技术,西汉的《淮南万毕术》、东汉的《神农本草经》都有用单质铁置换出铜盐中铜的记载,试写出用单质铁与 溶液反应进行湿法炼铜的化学方程式: 。
③黄铜是由铜和锌所组成的合金,其外观与黄金非常相似。将黄铜置于稀盐酸中,能观察到的明显现象是 (写出一条即可)。
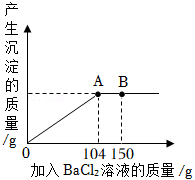
(2)现有 和 的固体混合物10g,将其全部放入一洁净的烧杯中,然后加入足量蒸馏水,搅拌,使固体完全溶解。再向烧杯中逐滴加入溶质质量分数为10%的 溶液,反应过程中产生沉淀的质量与所滴入 溶液的质量关系如图所示。试回答:
①当滴入 溶液150g时(即图中B点),烧杯中溶液里存在的酸根阴离子是 (填离子符号)。
②当滴入 溶液104g时(即图中A点),恰好完全反应,试通过计算,求10g该固体混合物中 的质量。(计算结果精确至0.1g)
科学探究是认识和解决化学问题的重要实践活动。
近年来,自热食品种类繁多。只需将撕去塑料膜的发热包放入凉水中,就能享用美食,很受年轻人的追捧。实验小组同学买来一份自热食品进行以下探究。
【资料】Ⅰ.发热包中物质的主要成分是生石灰、碳酸钠、铝粒。
Ⅱ.铝能和 溶液反应生成偏铝酸钠( )和氢气,偏铝酸钠溶于水。
探究一:发热包的发热原理。
(1)小组同学取出发热包,撕去塑料膜,放入适量凉水中,可观察到的现象是 ,固体迅速膨胀,同时还可观察到发热包内固体变硬结块,其可能的原因是 (用化学方程式表示)。
(2)在使用发热包过程中,禁止明火的理由是 。
探究二:反应后混合物中部分成分的探究。
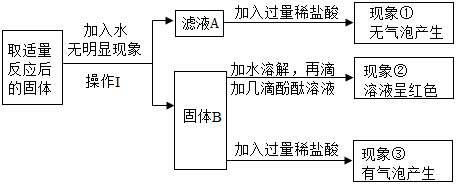
根据以上操作和实验现象回答下列问题。
(3)操作Ⅰ的名称是 。
(4)根据现象①得出:滤液A中一定不含的物质是 。根据现象②③分析得出:固体B中一定含有的物质是 。综合分析得出:现象③中产生的气体,其成分的组成可能为 。
(5)通过以上探究,同学们进行反思总结,你认为其中正确的是 。
| A. |
能与水混合放出热量的物质均可做发热包的发热材料 |
| B. |
发热包应密封防潮保存 |
| C. |
禁止用湿手接触发热包 |
| D. |
使用过程中应保持通风 |
科学探究离不开实验活动。
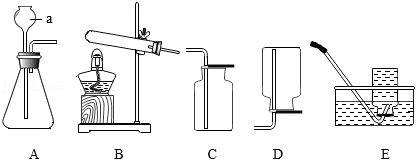
(1)仪器a的名称是 。
(2)实验室用加热高锰酸钾的方法制取氧气,并用于进行铁丝在氧气中燃烧的实验,最好选用的发生装置和收集装置是 。
(3)向装置A中加入少量氧化铜作催化剂,再向其中加入68g过氧化氢溶液,反应结束后,共产生1.6g氧气,写出该反应的化学方程式 ,所用过氧化氢溶液的溶质质量分数为 。
(4)实验小组同学用石灰石和6%的稀盐酸制取 时,发现固体仍有大量剩余,但不再产生气泡,请写出一种可能的原因 ,并设计实验进行验证 。
(5)以下反应均可生成 (极易溶于水,密度比空气小):
①
②
③
结合以上装置,适合作为实验室制取 的反应原理有 (填序号)。
从古至今,铁及其化合物一直被人类广泛应用。
(一)铁及其化合物的应用

(1)明代科学著作《天工开物》中记载:
①“其器冶铁锥,其尖使极刚利”,“铁锥”为开挖盐井的工具。所取盐井水“入于釜中煎炼顷刻结盐”,“金”指生铁制作的铁锅。生铁属于 材料。上述描述中利用铁的 (选填序号)。
| A. |
a.导热性 |
| B. |
b.导电性 |
| C. |
c.硬度大 |
②“泥固塞其孔,然后使水转釉”是指高温下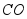 将红砖中的
将红砖中的 转化为
转化为 而形成青砖。该转化的化学方程式为 。
而形成青砖。该转化的化学方程式为 。
(2)铁的化合物在现代更多领域发挥着重要作用。
①碳酸亚铁( )不溶于水,可作补血剂,服用后与胃酸反应生成 被人体吸收,促进血红蛋白的生成。
)不溶于水,可作补血剂,服用后与胃酸反应生成 被人体吸收,促进血红蛋白的生成。
②火星探测器发回的信息表明,火星上存在 ,从而证明火星表面曾经存在过水,其理由为 。
,从而证明火星表面曾经存在过水,其理由为 。
③活性 可除去石油开采过程中的有害气体
可除去石油开采过程中的有害气体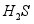 ,并获得
,并获得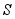 ,原理如下。
,原理如下。
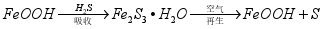
吸收中生成的另一种物质的化学式为 ,再生时发生反应的化学方程式为 。
(二) 的制备
的制备
用废铁屑(主要成分为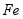 ,含少量
,含少量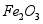 和
和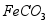 )制备
)制备 主要流程如下。
主要流程如下。
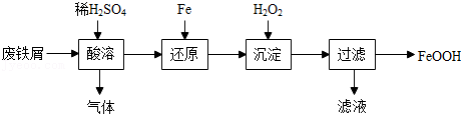
(1)酸溶时适当提高反应温度和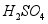 浓度,目的是 ,产生的气体为 。
浓度,目的是 ,产生的气体为 。
(2)还原发生的反应为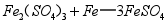 。
。
沉淀发生的反应为 。
。
沉淀时反应温度不宜太高,原因是 。
(3)沉淀时会有部分 与
与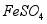 反应生成
反应生成 ,反应的化学方程式为 。
,反应的化学方程式为 。
(三) 的含量测定
的含量测定
已知: 及铁的氧化物加热分解的温度如下。
及铁的氧化物加热分解的温度如下。

称取含 的
的 样品76.6g,进行热分解实验。控制不同的温度对样品加热,测得剩余固体质量随温度的变化如图所示。
样品76.6g,进行热分解实验。控制不同的温度对样品加热,测得剩余固体质量随温度的变化如图所示。
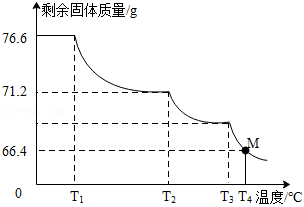
(1)样品中 的含量为 %(精确到0.1%)。
的含量为 %(精确到0.1%)。
(2)当加热到 时,M点固体的成分是 ,对应的质量比为 。
时,M点固体的成分是 ,对应的质量比为 。
氢是实现碳中和的能源载体。
(1)煤制氢的原理可表示为 。
① 中肯定含有的元素是 。
②煤制氢的不足是 (写出一点)。
(2)甲烷制氢包括重整、转化和分离等过程。甲烷制氢过程中产生的 和 的混合气分离得到 的过程如下:
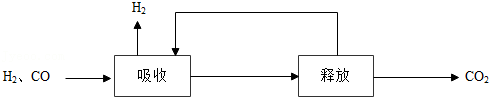
①海水作为吸收剂时,下列措施有利于海水吸收二氧化碳的是 (填序号)。
a.升高海水的温度
b.加快混合气的流速
c.增大气体的压强
②利用 溶液吸收 ,将其转化为 , 在加热条件下即可分解生成 。比较 和 分解反应的不同,可推知 的稳定性 (填“>”或“<”) 的稳定性。
③使用氢氧化钠溶液吸收二氧化碳并分离出氢气。补充完整氢氧化钠循环使用的方案。
步骤1:将氢气和二氧化碳的混合气通入足量的氢氧化钠溶液中。
步骤2:向步骤1所得的溶液中 。
步骤3:过滤,得滤渣和氢氧化钠溶液。
(3)某种利用太阳能制氢的过程如图1所示。
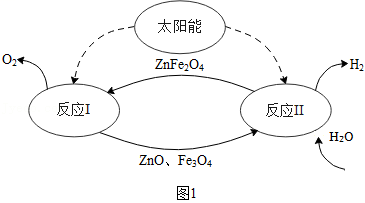
①反应I的基本类型为 。
②写出反应Ⅱ的化学方程式: 。
(4)我国2030~2050年各种能源使用预期情况如图2所示。
①图2所涉及的能源中,属于不可再生能源的是 。
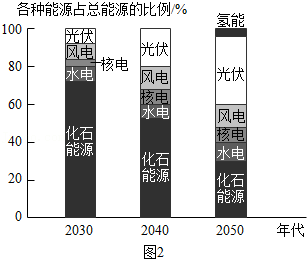
②2030~2050年,预期我国能源结构的变化趋势是 。