计算下列物质的相对分子质量或相对分子质量之和
⑴氯气(Cl2)
⑵二氧化锰(MnO2)
⑶碱式碳酸铜[Ca(OH)2]
⑷2CO2的相对分子质量之和
实验室里现有一包氯化镁和氯化钠的固体混合物样品,某同学取该样品12.8
,使之完全溶解在50
水中,再向其中加入40
%的氢氧化钠溶液,恰好完全反应.求:(计算结果用百分数表示,保留到小数点后一位数字)
(1)样品中氯化镁的质量.
(2)反应后所得溶液中氯化钠的质量分数.
某化学 兴趣小组采集一些石灰石标本,现要测定其中含碳酸钙的质量分数,他们取25克石灰石样品,加入足量的稀盐酸直到不再产生气体,测得共生成气体8.8克。
(1)计算实验中参加反应的碳酸钙质量;(8分)
(2)该石灰石样品中含碳酸钙的质量分数。
某校兴趣小组探究学校附近赤铁矿中Fe2O3的纯度。他们采集了80g矿样,粉碎后均分成四等份,分别置于四个烧杯中,然后分别向四个烧杯中加入同一浓度的稀硫酸,加入硫酸的质量与反应后剩余固体质量如下表所示。(假设矿石中的杂质既不和稀硫酸反应,也不溶于水)求:
| |
实验1 |
实验2 |
实验3 |
实验4 |
| 加稀硫酸质量 |
150g |
240g |
330g |
400g |
| 剩余固体质量 |
12g |
7.2g |
4g |
4g |
(1)该矿样中Fe2O3的质量分数。
(2)所用稀硫酸的溶质质量分数。
已知空气中氧气的体积分数为21%,试计算空气中氧气的质量分数。(结果保留一位小数)(提示1:空气中氧气的质量分数是指空气中扬起的质量百分数;提示2:空气的密度为1.293g/L氧气为1.429g/L)
医学上常用双氧水来清洗创口和局部抗菌。小美同学为了测定一瓶医用双氧水溶液的溶质质量分数,取该双氧水39g放入烧杯中,然后加入2g二氧化锰,完全反应后,称得烧杯内剩余物质的总质量为40.04g。请回答下列问题;
(1)二氧化锰在反应中的作用是 ,生成的氧气为 g。
(2)该双氧水溶液中过氧化氢的质量。(写出计算过程)
某学习小组同学用久置的过氧化氢溶液(如图)制取氧气,取2g二氧化锰于锥形瓶中,然后慢慢滴入34g过氧化氢溶液,充分反应。完成下列分析及计算:
⑴小明根据过氧化氢中氧元素的质量分数计算氧气的质量,其计算式为:
生成氧气的质量=34g×10%××100%
=34g×10%× ×100%=3.2g。
×100%=3.2g。
老师指出小明的计算是错误的,你认为错误的原因是 ▲ (填字母序号)。
A.过氧化氢的氧元素的质量分数计算有误
B.过氧化氢中的氧元素没有全部转移到氧气中
⑵请你根据化学方程式帮助小明计算理论上可制取氧气的质量。
⑶小亮思考:过氧化氢不稳定会自然分解,导致溶液中溶质的质量分数减小。实验结束后,称得锥形瓶内剩余物质的总质量是35.2g。请计算这瓶过氧化氢溶液中实际溶质的质量分数。
已知丙烯醇的化学式为C3H6O2,计算: (相对原子质量:H:1 C:12 O:16)
(1)丙烯醇中碳、氢、氧三种元素的质量比为 (54)
(2)丙烯醇中碳元素的质量分数(55)
低钠盐适合患有高血压、肾病、心脏病的患者服用,苹果酸钠盐(C4H5O5Na)是低钠盐的一种。请回答:
(1)苹果酸钠盐中钠元素的质量分数是 。(结果保留一位小数)
(2)苹果酸钠盐中各元素的质量比为C:H:O:Na = 。
(3)若某病人每天食用5.85g苹果酸钠盐,比食用相同质量的食盐(NaCl)少摄入钠元素多少克?(计算结果保留两位小数)
把5g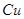 、
、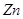 混合物加入到盛有50g稀硫酸的烧杯中,恰好完全反应,反应后烧杯内物质的总质量为54.8g,求
混合物加入到盛有50g稀硫酸的烧杯中,恰好完全反应,反应后烧杯内物质的总质量为54.8g,求
(1)加入稀硫酸的过程中会看到什么现象_________________________
(2)产生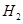 g?
g?
(3)最后所得溶液中溶质的质量为多少?
绿茶中含有茶氨酸(化学式为C7H14O3N2),有提高记忆力的功能,请计算:
(1)茶氨酸中氢、氮两种元素的原子个数比是 (最简整数比).
(2)茶氨酸中元素质量分数最大的是 元素.
儿童缺锌会引起食欲不振、发育不良。右图为某种补锌口服液说明书的一部分,请回答:

(1)葡萄糖酸锌中锌的质量分数为________ ____(计算结果精确到0.1%)
(2)若儿童1kg体重每日需要0.5mg的锌,每天从食物中只能摄入所需锌 的一半。体重为20kg的儿童每天还需服该口服液多少支才能满足身体需要。
右图是某品牌加碘盐的标签。

请根据图示信息回答下列问题:
(1)该加碘盐属于 (填“纯净物”或“混合物”)。
(2)标签上的“碘含量”中的“碘”是指 (填“元素”、“分子”、“原子” 或“离子”)。
(3)碘酸钾(KIO3)的相对分子质量为 。
(4)这包加碘盐中至少含有碘元素 mg。
(5)高温烹饪会使碘含量降低,说明碘酸钾受热 (填“易”“不易”)分解。