2011届江苏省泰州市初中毕业生学业考试化学模拟试卷(一)
下图为A、B、C三种固体物质的溶解度随温度变化的曲线图.请回答下列问题:
(1)40℃时,A、B、C三种物质的溶解度由小到大的顺序是________;请通过比较A、B两种物质的溶解度曲线,说明这两种物质溶解度变化的共同特点:_____________.
(2)若A为硝酸钾,60℃,将120 g A放入100 g水中,充分溶解后所得溶液的质量为______g.
某兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实
验。请你与他们一起完成以下探究活动:
【对固体猜想】
猜想I:全部是Na2CO3,猜想的依据是________________。
猜想Ⅱ:全部是NaOH。
猜想Ⅲ:部分是NaOH,部分是Na2CO3。
【实验和推断】
(1)若现象A为有气泡产生,则加入的X溶液是________________,说明氢氧化钠已经变质,有气泡产生的反应的化学方程式是 。
(2)若X是Ba(OH)2溶液,现象A为有白色沉淀生成,现象B为无色酚酞试液变红, 则白色沉淀为________(填化学式),该实验________(填“能”或“不能”)说明样品中有NaOH。
(3)若X是BaCl2溶液,猜想Ⅲ成立的实验现象是_____________________________,
___________________________。
小丽喜食豆腐.今天,小丽让妈妈为她做菠菜炒豆腐.可小丽的妈妈却告诉她菠菜不能与豆腐同食.
【提出问题】菠菜为什么不能与豆腐同食?
【查阅资料】草酸钙(CaC2O4)是不能被人体吸收的沉积物.豆腐中含有较多的钙盐[如硫酸钙(CaSO4)等],菠菜、洋葱、竹笋中含有丰富的草酸(H2C2O4)、草酸钠(Na2C2O4),豆腐和上述几种蔬菜混合食用,可能诱发“结石”症.
(1)由草酸的化学式可知其中碳元素的化合价为__________.
(2)草酸与硫酸钙反应的化学方程式为H2C2O4+CaSO4===CaC2O4↓+H2SO4,请写出草酸钠与硫酸钙反应的化学方程式:__________________.
【提出猜想】菠菜与豆腐同食可能会诱发“结石”症.
【设计实验】
| 实验步骤 |
实验现象 |
实验结论 |
| ①将菠菜在少量开水中煮沸2 min~3 min,取1 mL~2 mL滤液于试管中,并滴加少量_________溶液 |
产生白色 沉淀 |
有草酸钙 生成 |
| ②在步骤①的沉淀物 中加入过量醋酸 |
沉淀部分溶解, 且产生气泡 |
被溶解的沉淀一定 不是_____________ |
【发现新问题】被溶解的沉淀是什么?产生的气体又是什么?于是她又设计如下实验进一步探究:
| 实验步骤 |
实验现象 |
实验结论 |
| ③将步骤②产生 的气体通入__________中 |
______________ |
产生的气体是__________;步骤②被溶解的沉淀是碳酸钙 |
将铁粉和铜粉的混合物7g,加入到盛有58.1g稀盐酸的烧杯中,恰好完全反应。
此时烧杯内各物质的总质量为64.9 g。试计算:
(1)原混合物中铁粉的质量分数。
(2)反应后所得溶液中溶质的质量分数。(保留一位小数)
下列变化过程中只发生物理变化的是 ( )
| A.铜制品在潮湿的空气中变成铜绿 | B.用燃烧法区别羊毛和合成纤维 |
| C.以大米、高粱、小麦等粮食为原料酿酒 | D.气球充气过多爆炸 |
元素周期表是学习化学的重要工具,下图是元素周期表中的一格,从该图中,我们获取的相关信息中错误的是 ( )

| A.该元素的名称是镁 |
| B.该元素的原子序数为12 |
| C.该元素的原子结构示意图为 |
| D.该元素在地壳中的含量为24.31% |
下列对一些事实的解释中错误的是 ( )
| |
事 实 |
解 释 |
| A |
温度计中的水银(汞)热胀冷缩 |
原子的大小发生改变 |
| B |
进餐时,鱼刺、骨头若卡在咽喉处,可喝些醋 |
醋可和刺、骨中某成分作用 |
| C |
CO有毒而CO2无毒 |
两种物质的分子构成不同 |
| D |
有机物的数目异常庞大 |
原子的排列方式不同 |
下列关于化学实验操作的叙述中,正确的是 ( )
| A.做氧化铁炼铁的实验前无须检查装置的气密性 |
| B.稀释浓硫酸时,把浓硫酸沿容器壁慢慢注入盛水的量筒中 |
| C.给试管中的固体加热,试管口应略向下倾斜 |
| D.在未说明用量时,一般液体取5mL左右,固体盖满试管底部 |
下图表示治理汽车尾气所涉及反应的微观过程。下列说法不正确的是 ( )
| A.图中单质的化学式为N2 | B.该反应使有害气体转化为无害气体 |
| C.该反应属于置换反应 | D.生成单质与化合物的质量比为7:22 |
实验室中制备FeCl2有多种方法,其中可行的是 ( )
| A.2Fe+6HCl==2FeCl3+3H2↑ |
| B.FeO+2HCl="=" FeCl2+H2O |
| C.Fe(OH)2+2NaCl==FeCl2+2 NaOH |
| D.FeSO4+2HCl==FeCl2+H2SO4 |
为探究Zn和Cu的金属活动性强弱,提供的试剂有:Zn、Cu、H2SO4溶液、ZnSO4溶液、CuSO4溶液。下列说法正确的是
| A.选用两种试剂可实现实验目的 |
| B.ZnSO4溶液中加人Cu不能探究金属活动性强弱 |
| C.最多只能设计一种实验方案 |
| D.根据Zn和Cu的硬度能判断金属活动性强弱 |
下列有关氧气、水的说法正确的是
| A.氧气能支持燃烧,说明氧气具有可燃性 | B.硫在氧气中燃烧产生大量的白烟 |
| C.通过煮沸水可以降低水的硬度 | D.积极开发地下水可以保护水资源 |
某同学想用实验证明FeCl3溶液显黄色不是Cl-造成的,下列实验中无意义的是( )。
| A.观察KCl溶液没有颜色 |
| B.加水稀释后FeCl3溶液黄色变浅 |
| C.向FeCl3溶液中滴加适量无色硝酸银溶液,振荡后静置,溶液黄色未消失 |
| D.向FeCl3溶液中滴加适量氢氧化钠溶液,振荡后静置,溶液黄色消失 |
下列方案合理的是 ( )
| A.除铁锈:用过量的稀盐酸 |
| B.除去CO2中混有少量的CO :用点燃的方法 |
| C.制备NaOH溶液:将饱和的Na2CO3溶液与适量的石灰水混合后过滤 |
| D.鉴别H2、CH4、CO三种气体:分别将燃着的木条伸入集气瓶内,观察现象 |
类推是化学学习中常用的思维方法。下列类推结果不正确的是 ( )
| A.CaCO3能与稀盐酸反应生成CO2,碳酸盐都能与稀盐酸反应生成CO2 |
| B.H2点燃前需验纯,可燃性气体点燃前都需验纯 |
| C.NaOH能使无色酚酞溶液变红色,碱都能使无色酚酞溶液变红色 |
| D.硝酸铵溶于水会使溶液温度降低,能使溶液温度降低的物质不一定是硝酸铵 |
将镁、铁分别放入一定量的相同溶质质量分数的盐酸中反应(不计盐酸的挥发),产生等质量的氢气,现列举了如下四个理由:
①盐酸的质量相等,且盐酸均反应完毕②镁、铁质量相等,且镁、铁均已反应完毕
③镁、铁的质量比为3:7,盐酸足量 ④镁、铁质量相等,盐酸的质量也相等
你认为正确的是 ( )
| A.①③ | B.②③④ | C.①③④ | D.①②③④ |
从下列物质中选择填空(填化学式):铜、熟石灰、干冰、氧气、稀硫酸、烧碱
(1)供急救病人呼吸的是 (2)用于制作导线的是 ;
(3)用于改良酸性土壤的是 (4)用作制冷剂的是 ;
(5)用于金属表面除锈的是 (6)固体可用做干燥剂的是 。
节假日双休日,去野炊实为一大快事。然而,在野炊的情趣之中,如果遇到下面一些问题,你该如何处理?
(1)对野炊有经验的人会告诉你,餐具最好是导热性好,不易破碎的材料制成,你准备带的餐具时用 制成的;(填字母)
A.金属 B.陶瓷 C.无所谓
(2)野炊食谱如下:主食:馒头 配菜:红烧肉、豆腐汤、牛肉干。主食和配菜中主要含蛋白质、 、油脂、无机盐和水等营养素。从营养角度来看,你认为食谱还应添加 ;(填字母)
A.炒鸡蛋 B.牛奶 C.黄瓜 D.烤野兔肉
(3)用高锰酸钾制氧气时,收集到的氧气略显红色,可能的错误操作是________ ____。
(4)用水将pH试纸润湿后,再测某稀盐酸的pH,结果_________________(填“偏大”、“偏小”或“无影响”)。
(5)“低碳生活”是指生活作息时所耗用的能量要尽量少,减低二氧化碳排放量,从而减少大气污染,保护环境。下列做法符合“低碳生活”理念的是 (填序号)。
①节约使用天然气 ②提倡使用一次性木筷 ③大量砍伐森林树木
化肥厂生产合成氨的原料是煤、空气、水。生产简要流程如下:
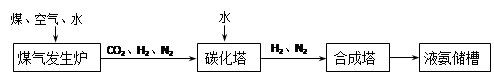 |
煤气发生炉中主要反应:①C + O2 = CO2;②C + H2O =" CO" + H2。两个反应必须进行调控才能保持一定的炉温。判断:反应② (填“放出”或“吸收”)热量。
将合成的氨气部分通入碳化塔,既除去了二氧化碳又得到了化肥NH4HCO3,试写出该反应的化学方程式 。
一种溶液里可能含有NO3-、Cl-、CO32-、SO42-四种 阴离子之中的一种或几种,取少量这种溶液分别盛放于两支试管中,进行如下实验:
(1)向第一个试管中加入BaCl2溶液时生成白色沉淀;
(2)向第二个试管中逐滴加入稀硝酸时,生成无色气体,该气体能使澄清石灰水变浑浊,继续加入稀硝酸使溶液显酸性时,再加入硝酸钡溶液不产生沉淀。
据实验推断:溶液中肯定不含有___________离子,可能含_________离子。
某探究小组同学对某工业废水(含有H2SO4、HNO3)中H2SO4的含量进行测定。
取50 g废水于烧杯中,加入足量BaCl2溶液,过滤、洗涤、干燥,得BaSO4固体11.65 g。
请回答:
(1)50 g废水中H2SO4的质量 。
(2)若改用KOH溶液来测定50 g废水中H2SO4的含量,结果可能会 (填“偏
低”、“偏高”、“不变”)
图中A~I表示几种初中化学常见的物质,“→”表示物质间存在相应的转化关系,部分反应物、生成物及反应条件已略去。已知圈i中的转化均是分解反应。圈ⅱ中的转化均是化合反应.D和G是常见的非金属单质,组成化合物E和H的元素种类相同。组成化合物F和I的元素种类也相同,A常用来中和土壤的酸性。
(l)写出化学式:A B
D F
(2)写出H→E+G的化学方程式:
(3)写出G→I的化学方程式:
敞口放置的氢氧化钠溶液易吸收空气中的二氧化碳而变质,请写出此过程的化学方程式: 。现向一定质量且部分变质的氢氧化钠溶液中逐滴加入稀盐酸,并振荡。如图表示反应过程中溶液质量随加入盐酸质量的变化而变化的情况。那么,图线BC段对应的实验现象是 ,在C点时溶液中的溶质是 。
氯化钠是日常生活的必需品,也是重要的化工原料。
(1)粗盐除含NaCl外,还含有少量MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是
粗盐提纯的操作流程。
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、饱和NaCl溶液。
①欲除去溶液I中的MgCl2、CaCl2、Na2SO4,从提供的试剂中选出a所代表的试剂,按正确滴加顺序依次为:过量的NaOH溶液、过量 、过量 ;
②在滤液中加盐酸的作用是 ;
(2) ①配制100克0.9%的氯化钠溶液时所需要的玻璃仪器有
②如果配制后溶液溶质的质量分数低于0.9%,你认为可能的原因是 。(填字母)
| A.称量NaCl的操作错误,如左盘放了纸片,右盘未放纸片 |
| B.用量筒量取水时错误,如取水时仰视读数 |
| C.烧杯中有水 |
| D.氯化钠中混有杂质 |
含有下列各组离子的溶液,其中的溶质都属于酸的是
| A.Na+H+SO42- | B.Ca2+ OH- Na+ | C.H+SO42- Cl- | D.K+ CO32- NO3- |
“神州七号”飞船返回舱进入大气层时会摩擦产生高温,其外表材料在高温时会发生下列变化带走热量,从而降低飞船温度,保证飞行员的安全。这些变化中属于化学变化的是
| A.汽化 | B.蒸发 | C.升华 | D.分解 |
一般说来,大多数作物适宜在中性或接近中性的土壤中生长。经测定某土壤的pH为5.5,要改良它,应在土壤中施加适量的
| A.氢氧化钠 | B.熟石灰 | C.食盐 | D.盐酸 |
右图为某粒子的结构示意图,下列说法中错误的是
| A.该元素原子的原子核外有2个电子层 | B.该元素是一种金属元素 |
| C.该粒子是阳离子 | D.该粒子具有稳定结构 |
银杏叶、果是防治高血压、心脏病重要的医药原料,银杏叶中提取物可以“捍卫心脏,保护大脑”。下列银杏生长过程中所施肥料属于复合肥的是
| A.KH2PO4 | B.CO(NH2)2 | C.K2SO4 | D.CaSO4、Ca(H2PO4)2 |
下列有关叙述中,正确的是
| A.20℃,100g水中溶解30g NaCl,所以20℃时NaCl的溶解度是30 g |
| B.NH4NO3固体溶于水,吸收热量 |
| C.饱和溶液降温后,都有溶质析出 |
| D.KNO3的饱和溶液一定比不饱和溶液浓 |
欲证明生石灰中含有未烧透的石灰石,最简单的方法是
| A.加热 | B.滴加稀盐酸 | C.加水溶解 | D.加入碳酸钠溶液 |
我国首部《食品安全法》将于今年6月1日颁布实施。下列做法能保证食品安全的是
| A.真空包装食品 | B.沥青公路上晒粮食 |
| C.给橙子“打蜡上色” | D.用工业酒精勾兑饮用酒 |
蛋白质是构成细胞的基本物质。下列不能与蛋白质发生化学反应的物质是
| A.甲醛 | B.硫酸铵 | C.浓硝酸 | D.乙酸铅 |
在两个烧杯中,分别装有质量相等的浓硫酸和浓盐酸。将它们分别在空气中放置一段时间,则
| A.浓盐酸的溶液质量增大 | B.浓硫酸的溶液质量增大 |
| C.浓盐酸的溶质质量分数不变 | D.浓硫酸的溶质质量分数变大 |
麦收季节,某些地方有就地焚烧秸杆的陋习。焚烧麦秸杆可能导致:①容易引发火灾;②能见度降低,引起交通事故;③诱发呼吸道疾病;④造成部分肥力损失。
| A.①②④ | B.②③④ | C.①②③ | D.①②③④ |
钾是人体必需的元素之一,若血液中钾元素含量偏低,易引发低钾血症,严重时会引发心率失常,甚至猝死。医学专家提醒:应重视日常补钾。可以服用的某种钾的化合物,其水溶液可以和硝酸银溶液反应,生成不溶于稀硝酸的白色沉淀。此化合物是
| A.KCl | B.K2CO3 | C.KNO3 | D.KOH |
2009年世界环境日主题为“地球需要你:团结起来应对气候变化”。下列应对气候变化的有关做法,不宜提倡的是
| A.提高森林覆盖率 | B.大量使用化石燃料 |
| C.响应“地球一小时”活动 | D.开发新能源 |
下列说法错误的是
| A.干电池放电时化学能转变成电能 |
| B.酸、碱和盐的组成中一定都含氧元素 |
| C.为防止矿井发生瓦斯爆炸,在进入矿井时要做灯火实验 |
| D.过氧化氢溶液中氢、氧元素的质量比一定大于1:16 |
图表资料可以为我们提供很多信息。下列从图表中获取的信息或相关应用错误的是
| A.从元素周期表中查找元素的原子序数、元素符号、相对原子质量 |
| B.根据金属元素在地壳的含量图,判断人类开发和使用金属的年代 |
| C.根据金属活动性顺序表,判断金属是否容易被盐酸腐蚀 |
| D.根据溶解度曲线图,选择从溶液中获得晶体的方法 |
下列图像中有关量的变化趋势与对应叙述关系正确的是 
| A.向一定质量表面生锈的铁片中滴加盐酸至过量 |
| B.向一定质量的稀硫酸中滴加水 |
| C.向盐酸和氯化铁的混合溶液中滴加氢氧化钠溶液至过量 |
| D.高温煅烧一定质量的石灰石 |
实验中,一种仪器与另一种仪器之间通常情况下不应该接触的是
| A.用胶头滴管向试管内滴加液体,胶头滴管与试管口 |
| B.用向上排空气法收集二氧化碳,导管口与集气瓶底 |
| C.向试管中倒液体药品,试剂瓶口与试管口 |
| D.过滤时,用烧杯承接滤液,漏斗下端尖嘴部位与烧杯内壁 |
下列各组物质,只用组内溶液相互混合,不能鉴别出来的是
| A.K2SO4、BaCl2、NaNO3、NaCl | B.HCl、Na2CO3、BaCl2、Na2SO4 |
| C.KOH、Na2SO4、CuSO4、HCl | D.MgSO4、NaOH、HNO3、BaCl2 |
用化学符号填空:
(1)2个汞原子____________; (2)甲烷分子_______________;
(3)3个硝酸根离子___________; (4)氯化镁中镁元素显+2价_______。
工业生产、人类生活与化学有着密切的关系,请你用C、H、O、Na、C1五种元素中的一种或几种(可重复使用)写出符合下列要求的物质的化学式:
(1)一种有毒气体,可用于铁的冶炼________;
(2)少量存在于人体胃液中,可帮助消化的酸性物质________;
(3)生活中常用于调味和腌渍蔬菜、鱼、肉等食物的盐________。
如图是a、b、c三种固体物质的溶解度曲线。
(1)点P表示______________________________。
(2)当温度为t2℃时的a、b、c三种物质的溶解度由大到小的顺序________。
(3)要使接近饱和的c物质的溶液变为饱和溶液,可采取的一种措施是_______________________。
(4)t2℃时,50g水中最多能溶解 a物质________ 。
学好化学能帮助我们更好地认识各种现象,更合理地解决生活中的实际问题。
(1)常用洗洁精洗涤油污,因为洗洁精与油、水混合会发生 作用。
(2)不同的情况下采用的不同的灭火方式。如在实验室里,不慎将酒精泼洒在桌面上着火应采取 ;扑灭因线路老化而引起的火灾时,应先 ,再进行灭火。
(3)家庭铝制品抗腐蚀性能较好,原因是 (用化学方程式表示)。
(4)富含淀粉的食品有 (只举一例),可用 检验。
水的硬度表示方法是:将水中的Ca2+、Mg2+质量折算成CaO的质量。通常把1L水中含有10mg CaO称为1度,1L水中含有20mg CaO即为2度,以此类推。8度以上为硬水,8度以下为软水。我国规定饮用水的硬度不能超过25度。
(1)日常生活中,可用 检验某水样是硬水还是软水。
(2)Ca(HCO3)2加热时会分解产生一种白色沉淀(水垢的主要成分)和两种常见的氧化物,请写出发生反应的化学方程式 。河水、井水中溶有一定量的Ca(HCO3)2,饮用前可采取 的方法来降低水的硬度。
(3)家用热水瓶一旦产生水垢,其保温性能会降低。用稀盐酸可除去上述水垢,发生反应的化学方程式为 。
(4)取某水样1L,经实验测定,其中含Ca2+0.2g,此水样的硬度约为 ,是否符合饮用水标准? 。
下图表示某些物质间转化关系(部分反应条件省略)。其中A为黑色固体氧化物;E为绿色固体;B、D是由相同元素组成的无色液体,且B具有消毒杀菌作用;C、Y为常见无色气体;X是常见的金属单质。
请回答下列问题:
(1)请判断X的化学式: 。
(2)反应①中A物质的作用是 。
(3)反应①、④、⑤的化学方程式:
① ;④ ; ⑤ 。
(4)反应③的基本反应类型属于 (填序号)。
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(5)在日常生活中为防止反应②的发生,可采取的措施是 (写一点即可)。
将下表内的A、B操作中必须先完成的操作的编号(即A或B)填在表中的答案栏内。
| 实验内容 |
操作A |
操作B |
答案 |
| (1)制备气体 |
加药品 |
检查装置的气密性 |
|
| (2)用排水法收集氧气完毕 |
将导气管移出水面 |
熄灭酒精灯 |
|
| (3)不慎将浓硫酸沾在皮肤上 |
用大量水冲洗 |
用布擦试 |
|
| (4)测定溶液的pH |
用玻璃棒蘸待测液滴到pH试纸上 |
与标准比色卡对照 |
|
某校化学兴趣小组的同学利用下图装置进行实验。
⑴实验目的:①用高锰酸钾制取一瓶氧气,做细铁丝燃烧的实验。
②粗略测定加热一定质量的高锰酸钾所收集到的氧气体积。
⑵反应原理:加热高锰酸钾制氧气。化学方程式为____________________________。
⑶仪器认识:写出上图中仪器①、②的名称:①______________,②______________。
⑷装置连接:为达到实验目的②,各装置的正确连接顺序是(填接口的字母):
a→( ) →( )→d
⑸问题分析:①实验过程发现B瓶中的水变红了,原因是_________________________;
②用收集到的氧气做细铁丝燃烧的实验时,发现瓶底炸裂,发生失误的操作原因可能是____________________________________________。
③根据高锰酸钾的质量算出产生的氧气质量为理论值。如果实际测得氧气的体积超过理论值,你认为原因可能是________________________。
现有失去标签的两瓶无色溶液:稀盐酸和氯化钠。某兴趣小组设计用化学方法和物理方法区分它们。请回答有关问题。
(1)化学方法:在不选用酸碱指示剂、pH试纸的情况下,按表中方法一(示例)填写。所选试剂须属不同类别(类别是指单质、氧化物、酸、碱、盐等)。
| |
所选试剂 |
判断方法 |
| 方法一 (示例) |
锌 |
取少量样品分别与锌粒反应,有气体产生的原样品是稀盐酸,没有气体产生的是氯化钠溶液。 |
| 方法二 |
|
|
| 方法三 |
|
|
(2)物理方法:同学小王仅使用了酒精灯和玻璃棒两种仪器,就把这两种无色溶液区分开来了。请你猜测一下他的做法(简要叙述操作方法)。
________________________________________________________________________。
过氧化钠(Na2O2)是一种淡黄色固体,常温下能与水和二氧化碳发生化学反应。某学校两个实验小组的同学为探究其与二氧化碳的反应,用下图所示的装置进行实验。一段时间后,将带余烬的木条插入试管D中,木条复燃。
请回答下列问题:
(1)B装置的作用___________________________。为了检验B装置的作用是否彻底,可在上图_________之间(填写装置序号)增加一个 (选填E或F)装置。
(2)第1小组同学认为Na2O2与CO2反应生成了Na2CO3和O2,则该反应的化学方程式为:________________________________________________________________________。
(3)第2小组同学认为Na2O2与CO2反应除生成Na2CO3和O2外,还有可能生成NaHCO3。你认为呢?简述理由____________________________________________________。
(4)装置D的作用是 。有同学设计实验方案,探究反应后试管D的溶液中是否有NaOH剩余,请帮助其完成下列实验报告。
| 实验方案 |
实验现象 |
有关化学方程式 |
实验结论 |
| ①取样,先向溶液中滴加过量的 溶液; |
产生白色沉淀 |
|
D溶液中有NaOH剩余。 |
| ②静置,取上层清液,滴加 溶液。 |
产生蓝色沉淀 |
|

 B.石蕊试液 C.烧碱溶液 D.稀盐酸
B.石蕊试液 C.烧碱溶液 D.稀盐酸

 粤公网安备 44130202000953号
粤公网安备 44130202000953号