铜镁合金具有优良的导电性,常用作飞机天线等导电材料.欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜合金20g放入烧杯,将280g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下.请计算:
| 次数 |
1 |
2 |
3 |
4 |
| 加入稀硫酸质量/g |
70 |
70 |
70 |
70 |
| 剩余固体质量/g |
18.2 |
16.4 |
14.6 |
13.2 |
(1)合金中铜、镁的质量比.
(2)所加稀硫酸的溶质的质量分数.(写出计算过程)
将
氧化锌固体放入
稀硫酸中,恰好完全反应.试计算:
①可生成硫酸锌多少克?
②所用稀硫酸的溶质质量分数是多少?(化学方程式:
)
某化学兴趣小组的同学对一份固体样品进行了探究.通过实验已确定该样品由氧化铁和铁粉混合而成.他们称取了13.6
固体样品,用图1所示的装置继续实验,测定的部分数据如图2所示.

请计算:
(1)固体样品中氧化铁的质量是克.
(2)在上述反应后的固体中加入100
稀盐酸,恰好完全反应,求反应后所得溶液中溶质的质量分数.(结果精确到0.1%)
氢化钙(
)固体是登山队员常用的能源提供剂.某化学兴趣小组拟用如图1所示的装置制备氢化钙,其反应的化学方程式为:
.

(1)
中钙和氢元素的化合价分别为,装置中的无水氯化钙干燥装置也可用来代替.
(2)利用该装置进行实验,步骤如下:检查装置的气密性后装入药品,打开分液漏斗活塞:(请按正确的顺序填入下列步骤的序号).
①加热反应一段时间 ②收集气体并检验其纯度 ③关闭分液漏斗活塞 ④停止加热,充分冷却
(3)为了确认进入装置C的氢气已经干燥,应在B、C之间再连接一装置
,装置
中加入的试剂是.若氢气未充分干燥,装置X中的现象为.
(4)为了测量上述实验中制得的氢化钙的纯度,该小组称取mg所制得样品,按如图2所示装置进行测定.旋开分液漏斗活塞,反应结束后充分冷却,注射器活塞由反应前的V1mL刻度处变化到V2mL刻度处(V2<V1,气体密度为dg/mL)
①橡胶管的作用为:a;b..
②旋开分液漏斗活塞后,除发生
的反应外,还最有可能发生的反应为.
③用w表示氢化钙的纯度,请用一个等式表示出d、V1、V2和w之间的关系.
④该小组乙同学认为去掉连接的注射器,也要计算出氢化钙的纯度.他同样称取mg样品,加入烧瓶中后称取反应前的质量为m1g,反应后的质量为m2g.乙同学表示出的m,m1,m2和w之间的关系的等式为.
100
某一定质量分数的稀硫酸恰好与13
锌完全反应.请计算:
(1)反应产生氢气的质量是
.
(2)稀硫酸中溶质的质量分数.(写出计算过程).
一块表面被氧化的铝片质量为15.6g,将其放入烧杯中,加入213g稀硫酸,恰好完全反应,反应后,称得烧杯中的溶液质量为228g,求:(提示: )
(1)生成氢气的质量为g;
(2)反应后所得溶液中溶质的质量分数.
草木灰是农家肥料,它的主要成分是碳酸钾,还有硫酸钾,氯化钾等,化学兴趣小组为测定某草木灰样品中的有效成分,取
草木灰于烧杯中,不断滴入稀硫酸溶液,当滴入
稀硫酸时,不再有气泡产生,此时烧杯中的残余混合物的质量为
.
碳酸钾与硫酸反应的化学方程式为
(假设草木灰的其他成分不含钾元素,不与酸反应)
请计算回答:
(1)二氧化碳(
)分子中,碳,氧元素的原子个数比为
(2)碳酸钾( )的相对分子质量为
(3)如图表示反应过程放出的气体质量与加入硫酸的关系曲线,请根据质量守恒定律求出图中纵坐标上
点数值:
;
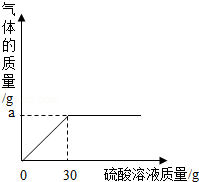
(4)草木灰样品中碳酸钾的质量(要求写出计算过程)
(5)通过其他实验,测得该
草木灰中硫酸钾质量为
,氯化钾质量为
,已知钾肥的有效成分以氯化钾计,则该草木灰样品中氯化钾的质量分数为
。
热水瓶胆水垢的主要成分是
和
,可用适量盐酸清洗除去.小红为测定水垢中碳酸钙的质量分数,进行了如下实验:取
水垢,往其中逐滴加入足量的稀盐酸,将产生的气体缓缓通入足量氢氧化钠溶液中,同时测量
内氢氧化钠溶液质量的变化值.所得结果如下表所示(忽略稀盐酸的挥发).
| 时间(
) |
|||||||||
| 氢氧化钠溶液增加的质量(g) |
(1)表中有一个时间测量的"氢氧化钠溶液增加的质量"数据是错误的,此时间是第
;
(2)
水垢溶于足量稀盐酸中,产生
的最大质量为
;
(3)计算水垢中碳酸钙的质量分数.
(4)请在如图坐标图中用正确的数据描绘出氢氧化钠溶液增加的质量与时间的变化关系图.

某纯碱样品中含有杂质
,为测定该样品中
的质量分数,称取纯碱样品
,放入
水中使其完全溶解,再加入稀盐酸
,恰好完全反应,反应后溶液的总质量为
。
试计算:(写出计算过程,结果保留一位小数)
(1)生成二氧化碳的质量;
(2)样品中
的质量分数;
(3)反应后所得溶液中溶质的质量分数。
我国是燃煤大国,燃煤机组发电在我国一直占主导地位。煤燃烧产生大量污染物,如氮氧化物、二氧化硫等,对于人体、环境和生态系统危害极大。近年来世界各国,尤其是工业发达国家都相继开展了同时脱硫脱硝技术的研究开发,并进行了一定的工业应用。尿素溶液可同时吸收氮氧化物、二氧化碳。总反应为:
请回答下列问题:
(1)请根据上述化学方程式,尿素溶液吸收
、
、
的质量比是。
(2)1000g尿素溶液完全反应,吸收污染物得到的硫酸铵132g。问所使用的尿素溶液的溶质质量分数是多少?
称取氯化钠和氯化钙的固体混合物14 g,放入烧杯中,加入96 g碳酸钠溶液恰好完全反应(反应的方程式为Na2CO3+CaCl2===CaCO3↓+2NaCl)。待反应完全后过滤,称得滤液的总质量为100 g。
(1)根据质量守恒定律,可知生成沉淀的质量为___________________________。
(2)固体混合物中氯化钙的质量是多少?
(3)所得滤液中溶质的质量分数是多少?
为测定某黄铜样品中锌的含量,某同学称取20g黄铜(铜和锌的合金)样品于烧杯中,向其中加入稀硫酸至不再产生气泡为止,共消耗100g质量分数为9.8%的稀硫酸,请计算:
(1)该黄铜样品中锌的质量。
(2)反应后所得溶液的溶质质量分数(计算结果保留0.1%)。
为测定某纯碱样品(含少量氯化钠杂质,不与稀盐酸反应)中碳酸钠的含量,取12g样品放入烧杯中,加入100g稀盐酸,恰好完全反应。经测定,所得溶液常温下为不饱和溶液,其质量为107.6 g(产生的气体全部逸出)。试计算:
(1)反应生成二氧化碳的质量为 g。
(2)稀盐酸中溶质的质量分数(写出计算过程)。
甲醇(CH3OH)是一种有毒、有酒精气味可燃性液体。甲醇在氧气中完全燃烧反应表示为:2 CH3OH+nO2=mCO2+pH2O(其中n、m、p表示化学计量数),若反应生成3.6g水。试计算:
(1)m值是 ;
(2)参加反应的氧气的质量是多少克?(请写出规范的计算步骤)
某化学实验小组的同学要测定某铁合金中铁元素质量分数(所含有的其他成分,不参加反应,且不溶于水), 他们的做法是:将7g铁合金样品粉碎,滴加14.6%的稀盐酸,至不再产生气泡时,恰好用去稀盐酸50g,请根据题意信息回答下列问题;
(1)铁合金样品溶解的化学方程式为 ;
(2)求解样品中铁的质量(X)的比例式 ;
(3)此铁合金样品中铁的质量分数 ;
(4)将最后所得的固液混合物过滤,除去不溶物,并在反应后溶液中加入44.6g水,则最后所得溶液的溶质质量分数为 ;
(5)欲炼制6300t该铁合金需要含氧化铁80%的赤铁矿石的质量为 。