实验室有一瓶新配制的稀盐酸(HCl气体溶于水得到的混合物为稀盐酸),其标签的部分内容如图所示。
(1)计算该稀盐酸中氯元素的质量分数。
(2)某实验小组用这种稀盐酸测定某石灰石样品中碳酸钙的质量分数,实验过程是:称取10g石灰石样品研成粉末,向其中加入7.3%的稀盐酸,产生二氧化碳的质量与加入盐酸的质量关系如图所示。(假设样品中的杂质都不和盐酸反应)计算石灰石样品中碳酸钙的质量分数。
人体缺少钙元素会影响健康,因此每日需摄入足够的钙。市场上某钙制剂的说明书如图所示,请仔细阅读,并进行计算。
(1)葡萄糖酸钙中碳、氧元素的质量比为 。
(2)葡萄糖酸钙(相对分子质量为430)中钙该元素的质量分数是 。(保留2位小数,下同)
(3)按用量服用每天摄入钙元素的质量是 。
称取NaCl和BaCl2的固体混合物32.5g,加入100g蒸馏水,完全溶解后向该混合溶液中逐滴加入质量分数为10%的Na2SO4溶液,反应生成BaSO4沉淀的质量与所加入的Na2SO4溶液的质量关系如下图所示。试回答下列问题:
(1)完全反应后生成BaSO4沉淀 g。
(2)恰好完全反应时消耗Na2SO4溶液的质量是 g。
(3)恰好完全反应时所得溶液中溶质的质量分数是多少?(精确到0.1%)
某纯碱样品中含有少量的氯化钠杂质。现称取6g该纯碱样品放在烧杯中并滴加稀盐酸。当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如下图所示。试回答:
(1)A点产生气体的质量m = 。
(2)B点时,烧杯内溶液中的溶质是 (写出化学式)。
(3)A点时溶液中溶质的质量分数(写出计算过程,结果精确到0.1%)。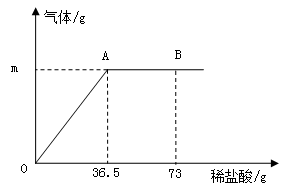
某厂生产的纯碱包装袋上标有Na2CO3 90%字样(杂质为NaCl)。为判断该纯碱是否合格,取12g样品放入烧杯中,加入100g稀盐酸,恰好完全反应。反应后所得溶液质量为107.6 g(产生的气体全部逸出,且知:Na2CO3 +2HCl=2NaCl+CO2↑+H2O)。
试计算:(写出计算过程)
(1)反应生成二氧化碳的质量;
(2)所用稀盐酸中溶质的质量分数;
(3)判断该纯碱产品是否合格。
金属单质A与非金属单质硫(S)发生如下反应: A + S  AS。甲、乙、丙三组学生在实验室分别进行该实验,加入的A和硫的质量各不相同,但总质量均为12g。 分别反应时,实验数据记录如下:
AS。甲、乙、丙三组学生在实验室分别进行该实验,加入的A和硫的质量各不相同,但总质量均为12g。 分别反应时,实验数据记录如下:
| |
A的质量/ g |
S的质量/ g |
AS的质量/ g |
| 甲 |
8 |
4 |
11 |
| 乙 |
7 |
5 |
11 |
| 丙 |
a |
b |
6.6 |
根据上述信息,计算(请写出计算过程):
(1)元素A的相对原子质量。
(2)丙组实验中a∶b为 (结果以最简整数比表示)。
请根据下列所示的实验过程和提供的数据,试回答下列问题:
(1)在滴入稀盐酸的过程中,观察到的明显现象是 。
(2)该反应过程中生成的CO2气体的质量 。
(3)求最终所得溶液中溶质的质量是多少?(请写出规范的计算过程,并且最后结果保留一位小数)
有一种自生氧防毒面具,其使用的生氧剂的主要成分是KO2。某研究小组取100 g生氧剂放入装置A中,加入足量水使之充分反应(4KO2+2H2O=4KOH+3O2↑),测定反应前后装置A的总质量。他们进行了三次实验,测定结果如下:
| 测定序号 |
第1次 |
第2次 |
第3次 |
平均值 |
| 反应前装置A总质量(g) |
400.1 |
400.2 |
399.7 |
400.0 |
| 反应后装置A总质量(g) |
376.1 |
376.1 |
375.8 |
376.0 |
请根据上述实验结果计算:(假设杂质不含钾元素且不与水反应)
(1)100 g 生氧剂与水反应生成的氧气质量;
(2)生氧剂中含钾元素的质量分数。
市售某品牌饮料的罐体是A1—Fe合金,为测定其中Al的质量分数,某学习小组精确称取0.050 g合金样品,设计了如下装置并进行实验: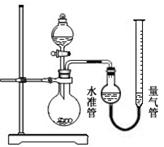
【查阅资料】:1、Al和NaOH溶液反应,放热并生成H2,反应中对应关系为2Al ~ 3H2,Fe和NaOH溶液不反应;2、实验条件下,H2的密度近似为0.090 g·L—1。
【实验步骤】:
① ;②装入药品和水,连接装置;③记录量气管中水面读数为5 mL;④打开分液漏斗活塞,逐滴滴入NaOH溶液,至不再产生气泡为止,关闭活塞;⑤待温度降至室温时,记录量气管中水面读数为49 mL;⑥处理剩余药品,整理实验台。
【实验分析及数据处理】:
(1)完善实验步骤中的所缺部分;
(2)检查气密性的方法:打开分液漏斗活塞,向量气管中加入水,使水准管和量气管中水面相平,关闭活塞,降低量气管,若两侧水面高度差 (填“改变”或“不变”),则气密性良好;
(3)实验结束后,读取量气管中水面刻度之前,需进行的操作是 ;
(4)计算此A1—Fe合金样品中Al的质量分数(3分,精确到小数点后3位); ;
【实验反思】:
(5)造成实验结果偏大的原因可能是 。
A.实验过程加入NaOH溶液的体积 B.没有冷却至室温就开始读数
C.装置漏气
某化学兴趣小组的同学设计了如下实验来验证二氧化碳气体的相关性质,实验步骤如下:
Ⅰ.取一个三通管(三个管口都未密封,与空气相通),在三通管的上部和下部各放一张湿润的蓝色石蕊试纸(湿润的蓝色石蕊试纸遇到酸性物质会变红)。然后将它与二氧化碳的发生装置连接。(如图1,整套装置的气密性良好)
Ⅱ.打开分液漏斗的活塞,使石灰石与稀盐酸接触,观察到相关现象后,停止实验。
Ⅲ.取下图1中的三通管,把贴有试纸B的那端放在酒精灯火焰上加热(如图2),
观察实验现象。
注:整个实验中不考虑反应过程中水分和HCl气体的挥发,且图1中产生的气流较缓慢
根据上述实验,回答下列问题:
(1)实验Ⅱ步骤中三通管内产生的实验现象是 __;由此说明二氧化碳气体具有 、 的性质。
(2)实验Ⅲ步骤中一定发生的化学反应方程式是 __;
(3)若不改变图1的实验装置,还要验证二氧化碳气体具有不能燃烧、也不能支持燃烧的性质,需要补充的实验是 __。
(4)取12g石灰石样品放入盛有105.4g稀盐酸溶液的烧杯中,恰好完全反应。有关实验数据如下表:(假设石灰石样品中杂质不与稀盐酸反应也不溶于水,且不考虑反应过程中水分和HCl气体的挥发)
| |
反应前 |
反应后 |
|
| 实验 数据 |
烧杯和稀盐酸的质量 |
石灰石样品的质量 |
烧杯和其中混合物的质量 |
| 150 g |
12 g |
157.6 g |
反应中生成二氧化碳的质量为 __g。
②该石灰石样品中碳酸钙的质量分数为 __(结果精确到0.1%)。
为测定石灰石中碳酸钙的质量分数,化学兴趣小组的同学设计了以下方案:将94.4g稀盐酸加入到15g石灰石样品中,恰好完全反应。生成的二氧化碳气体全部用足量的NaOH溶液吸收,NaOH溶液增加的质量随时间变化如下表:(友情提示:石灰石中的杂质不参加反应且难溶于水)
| 时间(min) |
t1 |
t2 |
t3 |
t4 |
t5 |
t6 |
t7 |
t8 |
| 氢氧化钠溶液增加的质量(g) |
1.5 |
2 |
2.5 |
3 |
3.5 |
4 |
4.4 |
4.4 |
求:(1)最终生成CO2的质量 ;
(2)样品中CaCO3的质量分数(计算结果精确到0.1%);
(3)将石灰石与稀盐酸反应后的剩余物质进行过滤,再向滤液中加入多少克水可以得到溶质质量分数为10%的CaCl2溶液。
向盛有22.3 g Na2CO3和NaCl固体混合物的烧杯中加入216.1 g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如下图所示:烧杯连同药品的起始质量为300 g。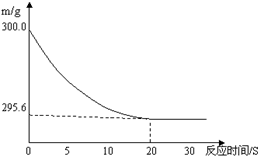
回答下列问题:
(1)当固体混合物与稀盐酸恰好完全反应时,所需时间约为 S。
(2)完全反应后,产生二氧化碳气体质量 g。
(3)反应后,得到室温下的不饱和溶液。所得溶液中溶质的质量分数为多少?
酒楼的食品在制作时常加人味精,味精是一种 有机化合物一谷氨酸钠,其化学式为C5H8NO4Na ,它的相对分子质量为169。右表 为某酒楼常见食品中味精的含量,根据题中的信息计算:
| 食品名称 |
500g食品的味精含量/mg |
| 春卷 |
400 |
| 排骨 |
240 |
| 水饺 |
130 |
(1)谷氨酸钠中碳、氢元素的质量比为 ;
(2)若某同学一次吃了200g春卷,则他会食用 mg味精,其中含钠元素的质量为 mg。
氯化钙钾石的化学式为KCl·xCaCl2(x是CaCl2的系数)。它是一种钾肥,溶于水后得到KCl和CaCl2的混合溶液。某化学兴趣小组为了测定氯化钙钾石中钾元素的质量分数,称取样品18.55g加水完全溶解得到KCl与CaCl2的混合溶液210g,向该溶液中逐滴加入Na2CO3溶液,产生的沉淀与加入Na2CO3溶液的质量关系如下图所示。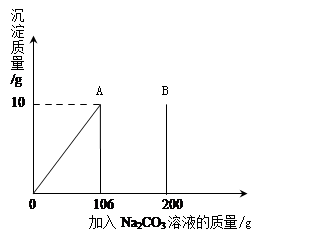
已知:Na2CO3 + CaCl2=CaCO3↓ + 2NaCl
请计算:
(1)氯化钙钾石中钾元素的质量分数。
(2)B点时溶液中Na2CO3的质量分数。
敞口放置的氢氧化钠容易吸水和变质。实验室中有220 g久置的的氢氧化钠固体样品(假设样品中各成分的分布是均匀的)。某实验小组从该样品中取出20 g,加热烘干其中的水分,得到18.6 g固体。向所得固体中加入过量的澄清石灰水,充分反应后得到10 g沉淀。对上述数据分析计算后,该小组同学向剩余的氢氧化钠样品中加入了一定量的氢氧化钙粉末和水,充分反应后,过滤,恰好得到了10%的氢氧化钠溶液。计算加入的氢氧化钙和水的质量。