[江苏]2012-2013学年江苏省扬州市江都区九年级第一学期期末化学试卷
当地土壤的重金属官方检测结果为镉含量超标0.59 mg/kg、铅含量超标60 mg/kg。这里的镉和铬是指
| A.元素 | B.原子 | C.分子 | D.金属单质 |
镉元素在周期表中的信息如右下图所示。则下列说法正确的是
| A.镉原子核内质子数为48 |
| B.镉原子相对原子质量为112.4g |
| C.镉是一种非金属元素 |
| D.镉原子中中子数为48 |
吸入氧化镉(CdO)的烟雾可产生急性镉中毒,氧化镉中镉元素的化合价是
| A.+1 | B.-1 | C.+2 | D.-2 |
镉、铅不是人体必需元素,下列不属于人体所需的微量元素是
| A.O | B.Cu | C.Fe | D.I |
下列做法中,合理的是
| A.用工业盐水生产酱油 | B.用地沟油烹饪食品 |
| C.用高毒农药防治作物病虫害 | D.用“84”消毒液清洗蔬菜水果 |
下列现象的微观解释中,不正确的是
| A.氧气和液氧都可助燃 —— 相同物质的分子,化学性质相同 |
| B.“八月桂花香” —— 分子在不断的运动 |
| C.水烧开后易把壶盖冲起 —— 温度升高,分子间隙变大 |
| D.水结冰体积膨胀 —— 温度降低,分子体积变大 |
CH4和某种氮氧化物反应的化学方程式为CH4+2 N2+CO2 +2H2O,则框内物质的化学式是
| A.NO | B.NO2 | C.N2O | D.N2O5 |
下列不能得到溶液的是
| A.碘加入酒精中 | B.酒精加入水中 |
| C.粉笔灰加入水中 | D.植物油加入汽油中 |
下列实验操作中,不正确的是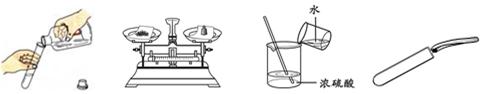
| A.倾倒液体 | B.称量NaCl | C.稀释浓硫酸 | D.取用固体 |
下列关于实验现象的描述,正确的是
| A.木炭在氧气中燃烧,红热并发出白光 |
| B.红磷在空气中燃烧,产生大量白色烟雾 |
| C.铁丝在空气中燃烧,火星四射,生成黑色固体 |
| D.石灰石和足量稀盐酸反应,石灰石逐步减少至消失,并生成气体 |
金属和酸溶液反应,不能生成的物质是
| A.MgCl2 | B.CuCl2 | C.Al2(SO4)3 | D.ZnSO4 |
下列依据实验目的所设计的实验操作中,正确的是
| 选项 |
实验目的 |
实验操作 |
| A. |
检验一瓶气体是否为CO2 |
将燃着的木条伸入瓶内 |
| B. |
除去CO2中的CO |
点燃 |
| C. |
除去衣服上的油渍 |
用洗洁精和水洗涤 |
| D. |
鉴别无水酒精和NaCl溶液 |
测导电性 |
2012年11月,中国白酒行业遭遇了塑化剂风波。DBP(化学式为C16H22O4)和DEHP(化学式为C24H38O4)是两种常见的塑化剂,下列关于它们的说法正确的是
A.DBP中有42个原子 B.DBP和DEHP均由C、H、O元素组成
C.DBP的相对分子质量是390 D.DBP和DEHP中O元素质量分数相同
下图是某化学反应的微观模拟示意图,下列说法错误的是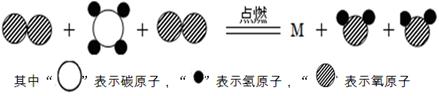
| A.反应前后原子种类、数目均不变 |
| B.该反应是置换反应 |
C.该反应的化学方程式为CH4 + 2O2 CO2+2H2O CO2+2H2O |
| D.该反应中,反应物的质量比是1:2 |
右图是A、B两种固体物质的溶解度曲线,下列说法正确的是
A.B物质为可溶物质
B.t2℃时,A、B饱和溶液中,溶质质量相等
C.提纯A(多)B(少)混合物中的A,可用冷却热饱和溶液结晶
D.A、B的饱和溶液从t3℃降温至t2℃,析出的晶体的质量一定是:A>B
向一定质量的硫酸铜溶液中加入不同质量的铁粉所呈现的信息如下表:
| Fe质量/g |
5.6 |
11.2 |
16.8 |
22.4 |
| Cu质量/g |
6.4 |
12.8 |
19.2 |
22.4 |
根据信息,下图所示关系正确的是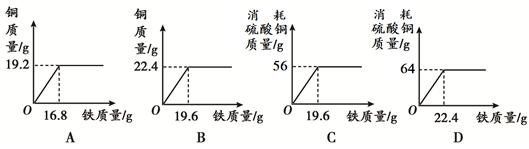
用化学用语填空:
①2个氢分子 ;②3个氧原子 ;③铜离子 ;④缺乏 元素,会导致骨质疏松,佝偻病;⑤+2的镁元素 。
生活处处皆化学。
(1)生活中的燃烧
①着火点比较:蜂窝煤 小木条(填“>”、“<”或“=”)。生煤炉过程中,不断扇入空气目的是 ,煤不完全燃烧产生一种有毒气体的化学式是 ;
②用水灭火的原理是 ,新型水成膜泡沫灭火剂扑灭油类火灾时,析出的液体和泡沫在油面上铺展形成一层水膜,进而灭火,原理是 。
(2)金属在生活中用途广泛
①下列生活用品,主要是由金属材料制成的是 ;
②用铁锅烹饪食物时,会有少量铁屑在胃部转化为可被吸收的Fe2+,反应的化学方程式为 ,是 反应(填基本反应类型)。
③用铝箔包装药物,主要利用了铝的 性;
④铜具有很好的 性,故可作导线。近代湿法冶金的先驱是指 (填化学方程式),铜和空气中的O2、H2O及 会生成铜锈[Cu2(OH)2CO3],反应的化学方程式是 。
(3)生活中的水和溶液
①处理自然水时,常用的混凝剂是 (填名称)。二氧化氯是一种新型的消毒剂,其化学式为 ;
②欲配制500mL 0.9%的生理盐水(密度为1.0 g/mL),需要NaCl的质量为 g;配制过程中,玻璃棒的作用是 ,称量NaCl时,若将砝码放在左盘(1 g以下用游码),其他操作均正确,则所配溶液中溶质质量分数将 0.9%(填“>”、“<”或“=”)
③右图是净化河水的简易装置,下列说法正确的是 ;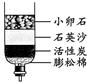
| A.净化后的水是纯净物 | B.此装置能对水杀菌消毒 |
| C.此装置能把硬水变为软水 | D.活性炭能吸附水中的色素及异味 |
④KNO3可用作配制无土栽培营养液,下表提供了KNO3在不同温度时的溶解度:
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
| 溶解度/g |
13.3 |
31.6 |
63.9 |
110 |
169 |
a.从上表可总结出KNO3的溶解度随温度变化的趋势是 ;
b.20℃时,将20gKNO3加入50g水中充分溶解,所得溶液的质量为 g;
c.现有60℃时的KNO3饱和溶液210 g,降温至20℃,会析出KNO3 g;
(4)食品包装学问大
①我区特产——嘶马羊耳采用真空包装,延长了食品的保质期,原理是 ;
②将N2充入包装袋内做保护气,是因为N2的化学性质 (填“活泼”或“稳定”);
③右图是“504双吸剂”的标签,请问答下列问题:
a.其中至少含有 种单质;
b.取少量双吸剂加入蒸馏水中,振荡后静置,测得上层清液的pH=9,若用pH试纸测定,具体操作是 。通入CO2后,上层清液变浑浊,写出上述变化的化学方程式 、 ;
c.为测定此双吸剂的使用效果,取足量双吸剂做了如右图所示的实验,一段时间后,进入试管中水的体积 21%(填“>”、“<”或“=”),理由是 ;
d.部分失效的双吸剂中,有红棕色固体,其主要是 ;
e.此双吸剂中,NaCl的作用可能是 。
现有下列装置,请回答问题: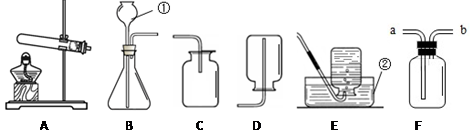
(1)写出有标号仪器的名称:① 、② ;
(2)用石灰石和稀盐酸反应制CO2,反应的化学方程式为 ,选用的发生装置是 ,收集装置是 ,验满的操作是 ;
(3)用一定质量的高锰酸钾制O2,反应的化学方程式为 ,选用的发生装置为 ,若实验后实际得到的氧气质量大于理论值,可能原因是 。
利用铝土矿(只考虑含Al2O3及Fe2O3)生产Al的工艺流程如下,请回答下列问题:
【查阅资料】:1、铝土矿中Al2O3可以和NaOH溶液反应,反应的化学方程式为:
Al2O3 + 2NaOH ="=" 2NaAlO2 + 2H2O;2、Fe2O3不和NaOH溶液反应。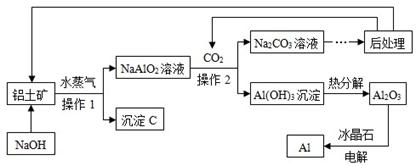
(1)工业生产中,要将铝土矿细磨预处理,目的是 ;
(2)沉淀C的化学式是 ;
(3)操作1、操作2的名称是 ,实验室完成此操作时,需要的玻璃仪器的是玻璃棒、烧杯和 ;
(4)此工艺中,可循环使用的物质是CO2、H2O和 ;(填化学式)
(5)电解Al2O3的化学方程式为 ;
(6)NaAlO2溶液中通入CO2反应的化学方程式是 。
市售某品牌饮料的罐体是A1—Fe合金,为测定其中Al的质量分数,某学习小组精确称取0.050 g合金样品,设计了如下装置并进行实验: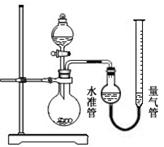
【查阅资料】:1、Al和NaOH溶液反应,放热并生成H2,反应中对应关系为2Al ~ 3H2,Fe和NaOH溶液不反应;2、实验条件下,H2的密度近似为0.090 g·L—1。
【实验步骤】:
① ;②装入药品和水,连接装置;③记录量气管中水面读数为5 mL;④打开分液漏斗活塞,逐滴滴入NaOH溶液,至不再产生气泡为止,关闭活塞;⑤待温度降至室温时,记录量气管中水面读数为49 mL;⑥处理剩余药品,整理实验台。
【实验分析及数据处理】:
(1)完善实验步骤中的所缺部分;
(2)检查气密性的方法:打开分液漏斗活塞,向量气管中加入水,使水准管和量气管中水面相平,关闭活塞,降低量气管,若两侧水面高度差 (填“改变”或“不变”),则气密性良好;
(3)实验结束后,读取量气管中水面刻度之前,需进行的操作是 ;
(4)计算此A1—Fe合金样品中Al的质量分数(3分,精确到小数点后3位); ;
【实验反思】:
(5)造成实验结果偏大的原因可能是 。
A.实验过程加入NaOH溶液的体积 B.没有冷却至室温就开始读数
C.装置漏气


 粤公网安备 44130202000953号
粤公网安备 44130202000953号