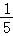下列说法正确的是( )
| A. |
某氧化钙和碳酸钙的混合物中钙元素的质量分数为60%,将50g该混合物高温煅烧至固体质量不再改变,剩余固体的质量是42g |
| B. |
120g 尿素[CO(NH 2) 2]与150g硝酸铵中氮元素的质量相等 |
| C. |
用含氧化铁85%的赤铁矿石160t,理论上可炼出含杂质3%的生铁80t |
| D. |
现有氢氧化钾和氯化钾的混合物20.5g,向其中加入100g质量分数为3.65%的稀盐酸,恰好完全反应,则原混合物中钾元素的质量为11.7g |
将16g纯净物R在足量氧气中完全燃烧,生成44g二氧化碳和36g水。下列判断正确的是( )
| A. |
R只含碳、氢元素 |
| B. |
消耗氧气32g |
| C. |
R含碳、氢、氧三种元素 |
| D. |
R中碳元素的质量分数为70% |
某学习小组进行盐酸与氢氧化钠的中和反应实验时,在常温下,向一定量的某溶液中滴加X溶液,得到了如图所示的pH变化曲线。下列说法正确的是( )
| A. |
X是盐酸 |
| B. |
向a点的溶液中加入硫酸铜溶液产生蓝色沉淀 |
| C. |
b点表示盐酸和氢氧化钠恰好完全反应 |
| D. |
c点溶液中的阴离子只有OH ﹣ |
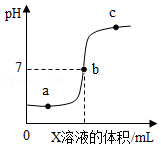
向AgNO 3和Cu(NO 3) 2的混合溶液中缓慢连续加入m克锌粉,析出固体的质量与加入锌粉的质量关系如图所示,下列分析不正确的是( )
| A. |
向N点对应溶液中加入氯化钠溶液,有白色沉淀产生 |
| B. |
P点对应的固体一定有Cu,可能有Ag |
| C. |
Q点对应的溶液为无色,此时溶液的溶质无Cu(NO 3) 2,只有Zn(NO 3) 2 |
| D. |
加入m克锌粉后,过滤,向滤渣中加入稀盐酸,有气泡产生 |
某小组同学在探究过程中,通过观察与实验,推理与判断,如不考虑水分蒸发,最后得出的结论正确的是( )

| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
|
| 溶解度/g |
熟石灰 |
0.18 |
0.16 |
0.14 |
0.11 |
0.09 |
| 硫酸铜晶体 |
14.3 |
20.7 |
28.5 |
40 |
55 |
|
| A. |
①中溶液的溶质质量分数为16% |
| B. |
②中加入氢氧化钠的过程中,有氢氧化钙析出 |
| C. |
③中棉线上析出晶体的质量一定是34.3g |
| D. |
④中加入氢氧化钠前、后均为硫酸铜饱和溶液 |
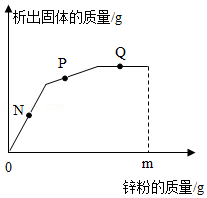
在一密闭容器中,有甲、乙、丙、丁四种物质,反应前各物质的质量关系如图刻度纸所示(例如:丙的质量为5g,丁的质量为3g),充分反应后,在同一张刻度纸上再次记录各物质的质量变化:刻度线Ⅰ向左移动16格;刻度线Ⅱ向左移动8格;刻度线Ⅲ向左移动8格。下列说法正确的是( )
| A. |
该反应是化合反应 |
| B. |
丙一定是催化剂 |
| C. |
反应后丁的质量为8g |
| D. |
反应生成的乙和丁的质量比为1:1 |
向盛有CuSO 4和H 2SO 4混合溶液的烧杯中,逐滴加入NaOH溶液至过量,沉淀质量、溶质质量和溶剂质量随NaOH溶液质量变化关系如图所示。下列说法错误的是( )
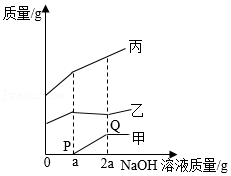
| A. |
乙代表溶质质量 |
| B. |
Q点溶液中溶质为Na 2SO 4 |
| C. |
O→P过程反应的化学方程式为2NaOH+H 2SO 4═Na 2SO 4+2H 2O |
| D. |
原溶液中CuSO 4和H 2SO 4质量相等 |
某兴趣小组用如图装置(夹持仪器省略)制取纯净、干燥的氢气,并还原Co 2O 3(提供试剂有:AgNO 3溶液、NaOH溶液、浓硫酸)。下列说法正确的是( )

| A. |
装置①内的导管应为进气管长,出气管短 |
| B. |
实验结束,先关闭恒压漏斗活塞,再停止加热 |
| C. |
装置②、③、④中依次盛装NaOH溶液、AgNO 3溶液、浓硫酸 |
| D. |
生成物H 2O中氢元素的质量与参加反应的HCl中氢元素质量相等 |
下列实验方案不能达到实验目的的是( )
| 选项 |
实验目的 |
实验方案 |
| A |
除去粗盐水中的Mg 2+、Ca 2+、SO 4 2 ﹣,得到精盐水 |
依次加入过量的Na 2CO 3溶液、BaCl 2溶液、NaOH溶液,充分反应后过滤 |
| B |
鉴别CaCO 3、NaOH、NaCl、NH 4NO 3四种固体 |
加水,观察溶解和温度的变化情况 |
| C |
除去氧化钙中的碳酸钙 |
高温煅烧 |
| D |
区分棉纤维、涤纶、羊毛线 |
点燃,观察现象并闻气味 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
如图是a、b、c三种固体物质的溶解度曲线,下列分析正确的是( )

| A. |
t 1℃时a、c两物质溶液中溶质的质量分数相等 |
| B. |
t 2℃时,物质a的100g饱和溶液中含有25g物质a |
| C. |
t 2℃时,分别将a、b、c的饱和溶液降温至t 1℃,溶质质量分数关系是b>a=c |
| D. |
t 2℃时向50g水中加入15g物质b充分搅拌,所得溶液质量一定小于65g |
有一包白色粉末,可能含有Na 2CO 3、Na 2SO 4、K 2SO 4、NaCl、Ba(OH) 2中的一种或几种,为了探究其成分,实验过程如图所示:
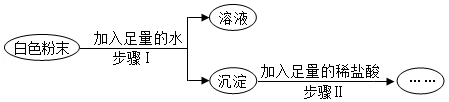
关于该实验的说法正确的是( )
A.步骤Ⅱ中沉淀部分溶解,则原白色粉末一定有Ba(OH. 2、Na 2CO 3、K 2SO 4
B.步骤Ⅱ中沉淀部分溶解,则原白色粉末的组成可能有5种情况
C.步骤Ⅱ中沉淀全部溶解,则原白色粉末一定有Ba(OH. 2、Na 2CO 3,可能有NaCl
D.步骤Ⅱ中沉淀不溶解,则原白色粉末一定有K 2SO 4,一定没有Na 2CO 3
下列图像与对应的叙述,相符合的是( )
A.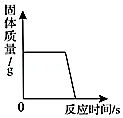 高温煅烧石灰石
高温煅烧石灰石
B. 氢气和氧气在密闭容器中燃烧
氢气和氧气在密闭容器中燃烧
C.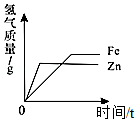 向等质量的铁粉和锌粉中分别加入等质量分数的稀硫酸至过量
向等质量的铁粉和锌粉中分别加入等质量分数的稀硫酸至过量
D. 在一定温度下,向硝酸钾的饱和溶液中加入硝酸钾晶体
在一定温度下,向硝酸钾的饱和溶液中加入硝酸钾晶体
为确定某溶液中含有以下离子H+、Mg2+、Ba2+、Cl﹣、CO32﹣、NO3﹣中的几种,进行了以下实验:
①经测定,溶液pH=1;
②取部分未知溶液,加入过量NaOH溶液,有白色沉淀产生;
③取②中部分溶液,加入Na2CO3溶液,无明显现象。
分析上述实验,下面对溶液中含有离子的判断,正确的是( )
A.一定含有H+、Mg2+、Ba2+、Cl﹣、NO3﹣
B.一定含有H+、Mg2+、Cl﹣,一定不含有CO32﹣
C.一定含有H+、Ba2+、NO3﹣,一定不含有Cl﹣
D.一定含有H+、Mg2+,可能同时含有Cl﹣、NO3﹣
如图是测定空气中氧气含量的实验。对该实验的认识不正确的是( )
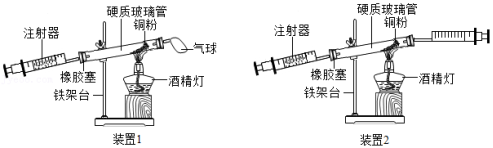
A.要等到装置冷却至室温后再读数,否则测定结果偏小
B.该实验中的铜粉换成铁粉无法达到实验目的
C.将装置1中的气球更换为注射器(见装置2),可使空气与铜粉接触更充分,数据更加准确
D.正确操作情况下,反应消耗氧气的体积应该是反应前注射器内气体和玻璃管内气体体积总和的