下列实验设计能达到实验目的是
| 序号 |
实验目的 |
实验方案 |
| A |
检验某气体是否为二氧化碳 |
用燃着的木条 |
| B |
稀释浓硫酸 |
将水缓慢加入浓硫酸中,并搅拌 |
| C |
区分氧化钙与碳酸钙 |
取样品,加入适量水 |
| D |
除去K2S04溶液中的K0H |
加入适量稀盐酸 |
有三瓶无标签的无色溶液,只知道它们分别是NaOH、NaCl、BaCl2中的各一种。下列四种溶液中,能将三种无色溶液一次鉴别出来的是
| A.Na2SO4溶液 | B.AgNO3溶液 | C.酚酞试液 | D.CuSO4溶液 |
赤铜是一种铜的氧化物,因其外观与铜粉的颜色相似,故名“赤铜”。某兴趣小组欲确证草酸晶体的热分解产物,并测定赤铜的化学式,请你参与过程分析。
【资料】1、草酸晶体(H2C2O4·3H2O)在浓硫酸作用下受热分解,化学方程式为:
H2C2O4·3H2O=CO2↑+ CO↑+ 4H2O
2、浓硫酸具有吸水性,常用作气体干燥剂;无水硫酸铜遇水分变蓝色
(1)下列可用作草酸晶体在浓硫酸作用下加热分解的装置是 (填字母编号)。
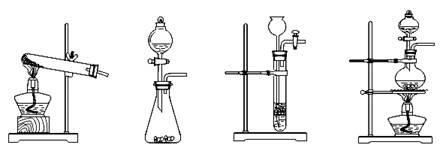
a b c d
【问题讨论】
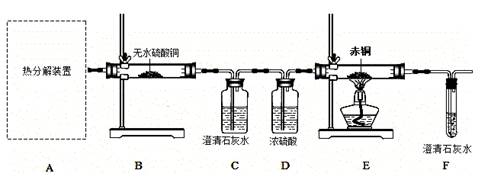
用上图所示装置进行实验(装置C中澄清石灰水足量):
(2)该兴趣小组进行上述实验时,先点燃热分解装置中的酒精灯,一段时间后再点燃E处的酒精灯,原因是 。
(3)B装置的作用是 。证明草酸晶体的热分解产物中有CO2的现象是 ,该反应的化学方程式为 。
(4)从环保角度考虑,该套实验装置的明显缺陷是 。
【数据分析与计算】
(5)称取赤铜样品7.2g(假设样品是纯净物),用上述装置进行实验,待赤铜完全反应后,测得E装置玻璃管内固体粉末的质量为6.4克,试计算确定该赤铜的化学式。(写出计算过程)
(6)根据你求出的赤铜化学式,写出E装置中发生反应的化学方程式 。
K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备K2SO4和Mn3O4的工艺流程如下:
【相关资料】(1)含水结晶盐受热时通常先失去结晶水;
(2)图2中物质B就是工业产品Mn3O4 ;
(3)Mn3O4在高温时会被氧化,且锰的化合价从+1到+7变化时逐级升高,如+2的锰先氧化到+3的锰,再从+3氧化到+4分别是对应的氧化物为三氧化二锰和二氧化锰。
【问题解答】
(1)反应II中加入的NH4HCO3中氮元素的化合价为 ;
(2)反应Ⅲ中,向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行蒸发浓缩、结晶、 、洗涤、干燥等操作即得K2SO4晶体;
(3)试分析反应Ⅲ后有K2SO4析出的原因是____________________________;
(4)加热MnSO4·H2O固体时第一次质量减少的原因是 (用化学方程式表示);
(5)煅烧过程中固体锰元素的质量分数随温度的升高而增大。但当温度超过1000℃时,再冷却后,测得产物中的锰元素的质量分数反而减小。试分析产物中锰元素的质量分数减小的原因: 。
下列实验中利用提供的方案不能达到目的是
| 选项 |
实验目的 |
实验方案 |
| A |
稀释浓硫酸 |
将浓硫酸沿器壁慢慢注入水里,并不断搅拌 |
| B |
鉴别氮气和氧气 |
将带火星的木条插入集气瓶中,看是否复燃 |
| C |
测某溶液的酸碱度 |
滴入酚酞试液,观察溶液颜色的变化 |
| D |
除去固体氯化钾中少量的二氧化锰 |
加水溶解后,过滤、蒸发 |
图中的A~H是初中化学常见的化合物,且分别是由H、O、S、Na、Ca、Cu中的两种或三种元素组成的。其中B、E是氧化物,E中两种元素质量之比为2:3;C、F、H为相同类别的化合物,F易溶于水并放出大量的热;G的溶液呈蓝色。图中的"-"表示两端的物质间能发生化学反应;"→"表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。

(1)G的化学式为。
(2)写出E和F反应的化学方程式。
(3)G和H反应的基本反应类型为。
(4)写出C→B发生分解反应的化学方程式:。
下表中除去物质中所含少量杂质的方法正确的是()
| 选项 |
物质 |
所含杂质 |
除杂质的方法 |
| A |
氯化亚铁溶液 |
氯化铜 |
加适量的铁粉、充分反应后过滤 |
| B |
硫酸钠溶液 |
硫酸 |
加过量的碳酸钠溶液 |
| C |
铁 |
硫酸铜 |
加适量的水溶解、过滤、洗涤、干燥 |
| D |
一氧化碳 |
二氧化碳 |
将气体先通过足量的氢氧化钠溶液,再通过足量的浓硫酸 |
| A. |
|
| B. |
|
| C. |
|
| D. |
|
下列图象中有关量的变化趋势正确的是
| A.某温度下,向一定量不饱和硝酸钾溶液中不断加入硝酸钾晶体 |
| B.向一定量的稀盐酸中逐滴滴加水 |
| C.向一定量的氢氧化钠和碳酸钠的混合溶液中逐滴滴加盐酸 |
| D.将水通电电解一段时间 |
化学课后,化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究:
【提出问题1】该氢氧化钠溶液是否变质了呢?
【实验探究1】
| 实验操作 |
实验现象 |
实验结论 |
| 取少量该溶液于试管中,向溶液中滴加 , 并不断振荡. |
有 产生. |
氢氧化钠溶液一定变质了. |
【提出问题2】该氢氧化钠溶液是全部变质还是部分变质呢?
【猜想与假设】
猜想1:氢氧化钠溶液部分变质.
猜想2:氢氧化钠溶液全部变质.
【查阅资料】
(1)氯化钙溶液呈中性.
(2)氯化钙溶液能与碳酸钠溶液反应:CaCl2+Na2CO3=CaCO3↓+2NaCl
【实验探究2】
| 实验步骤 |
实验现象 |
实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量的 溶液,并不断振荡. |
有 生成. |
说明原溶液中一定有碳酸钠. |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液. |
溶液变红色. |
说明原溶液中一定有 . |
【实验结论】该氢氧化钠溶液 (填“部分”或“全部”)变质.
【反思与评价】
(1)氢氧化钠溶液露置于空气中容易变质,请写出相关反应的化学方程式: .
(2)在上述[实验探究2]中,小明提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案 (填“可行”或“不可行”).
海洋是一个巨大的资源宝库,海水中有大量可以利用的化学资源,例如氯化镁、氯化钠、溴化钠等.如图为综合利用海水制备金属镁的流程.
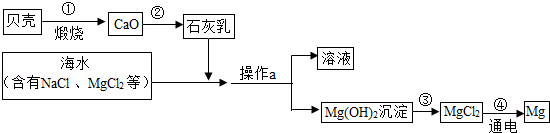
该流程中没有涉及的化学反应是( )
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
如图所示,在盛有稀硫酸的烧杯中,滴加几滴氯化钡溶液后,在烧杯里的溶液中离子数目的变化是
| A.Cl-增多了,SO42-减少了 | B.Ba2+增多了,H+减少了 |
| C.Cl-增多了,H+减少了 | D.H+减少了,SO42-减少了 |
化学老师交给某研究性学习小组一个任务:测定实验室里一瓶久置的NaOH固体是否变质。该小组的同学进行了如下实验探究:
【提出问题】 猜想I:没变质,全部是NaOH;猜想II:部分变质,既含有NaOH又含有Na2CO3:猜想Ⅲ:完全变质,全部是Na2CO3。
【查阅资料】①已知反应:BaCl2+Na2CO3=2NaCl+BaCO3↓
②部分盐溶液在常温下的pH如下:
| 盐溶液 |
NaCI |
Na2CO3 |
BaCl2 |
| pH |
等于7 |
大于7 |
等于7 |
【设计方案并进行实验】请你与他们一起共同完成,并回答所给问题:
| 实验步骤 |
实验现象 |
实验结论 |
| ①称取上述氢氧化钠固体样品8.0g溶于50ml,水配成溶液,向溶液中滴加氯化钡溶液至过量,充分反应后,静置。 |
产生白色沉淀 |
说明久置固体中,一定含有 (填化学式)。 |
| ②用玻璃棒蘸取少量①中充分反应后的上层清液滴在一小块pH试纸上,与标准比色卡对比,测出pH |
pH=11 |
说明久置固体中,还一定含有 (填化学式)。 |
上述步骤①中,所用称量仪器的名称是 ,滴加过量BaCl2溶液的目的是
【实验结论】通过实验,说明上述猜想中 是正确的。
【反思】久置的氢氧化钠变质的原因是
(用化学方程式表示)。
【表达与交流】在实验室里氢氧化钠需要密封保存。药品密封保存的原因很多,请你写出浓盐酸需要密封保存的原因 。
下列实验设计能达到实验目的是( )
| 选项 |
实验目的 |
实验方案 |
| A |
检验某气体是否为二氧化碳 |
用燃着的木条 |
| B |
稀释浓硫酸 |
将水缓慢加入浓硫酸中,并搅拌 |
| C |
区分氧化钙与碳酸钙 |
取样品,加入适量水 |
| D |
除去K2S04溶液中的K0H |
加入适量稀盐酸 |
除去下列物质中的少量杂质,方法错误的是
| 选项 |
物质 |
所含杂质 |
除杂质的方法 |
| A |
通过足量的氢氧化钠溶液,干燥 |
||
| B |
加入足量的稀硫酸,过滤,洗涤,干燥 |
||
| C |
加入适量的稀盐酸,过滤,洗涤,干燥 |
||
| D |
溶液 |
加入适量的氢氧化钾溶液,过滤 |
某化学兴趣小组在做完制取二氧化碳的实验后(用石灰石和稀盐酸制取),对反应后反应器内的剩余溶液的溶质成分产生了兴趣,他们继续进行了以下实验探究。
【分析推断】根据制取二氧化碳的反应原理,可以确定剩余溶液中一定含有氯化钙。但其中是否含有氯化氢需要通过实验来证明。若剩余溶液显酸性(含有H+),说明含有氯化氢。
【查阅资料】碳酸钙不溶于水,氢氧化钙微溶于水,氯化钙溶液呈中性。
【实验过程】将剩余的溶液倒入烧杯中,微热后冷却到室温。
| |
实验操作 |
实验现象 |
实验结论 |
| 甲同学 |
取烧杯中溶液少许于试管中,向其中滴加①____________ |
现象:溶液变为红色 |
溶液显酸性(含有H+);溶质中有氯化氢。 |
| 乙同学 |
取烧杯中溶液少许于试管中,向其中加入少量锌粒 |
现象:②_____________ |
|
| 丙同学 |
取烧杯中溶液少许于试管中,向其中加入少量石灰石 |
现象:③_________________ 化学方程式为: ④______________________ |
【拓展提高】若要从剩余溶液中得到尽可能多的纯净的氯化钙固体,同学们认为可以向剩余溶液中加入稍过量的 ⑤__________(填化学式),经 ⑥___________、蒸发等操作后即可完成。