将下列四个实验所验证或探究的目的填写在横线上,并回答相关问题.
(1)在实验A中使用的计量仪器是 (填仪器的名称,下同)。在上述四个实验中有三个实验都使用了的同一种仪器是 。
(2)在实验D中观察到的现象是 。在实验A和实验C中观察到的相同现象是 ,在实验A和实验C中反应的化学方程式是 。
生活中处处有化学,通过学习已经知道:
①地壳中含量最多的金属元素的符号是 。
②“促进低碳经济”,警示温室效应对人类的危害。引起温室效应的主要气体是 。
③活性炭作为家用冰箱除味剂,是因为它具有 作用。
④草木灰的主要成分是 (填化学式),它的类别属于 (填“酸”“碱”“盐”), 如果将草木灰的主要成分放在火上灼烧,透过钴玻璃火焰呈 色。
小红用实验研究CO2通入水中后发生的变化.
(1)如图甲所示,向一个收集满CO2气体的质软的塑料瓶A中加入约 体积的水,立即旋紧瓶盖,振荡,产生的现象为 .
体积的水,立即旋紧瓶盖,振荡,产生的现象为 .
(2)取3mL瓶A中的液体倒入试管B中,滴加紫色石蕊溶液,振荡,观察到溶液颜色变为 色,说明CO2与水发生了化学反应,该反应的化学方程式为 .
(3)将(2)中试管B继续做如图乙所示的实验.实验中可观察到的实验现象为 ;C中反应的化学方程式为 .
如图是实验室制取CO2,并验证CO2和CO的性质的实验,请看图后回答问题。
(1)写出标有序号的仪器名称① ② 。
(2)A中反应化学方程式为 。
(3)B中反应化学方程式为 。
(4)C中反应化学方程式为 。
(5)D中反应化学方程式为 。
(6)E处放一点燃的酒精灯的目的是 。
国家卫生部规定:从2011年5月1日起公共场所禁止吸烟.
(1)烟草燃烧产生的烟气中含有的 _________ 能与血红蛋白结合,危害人体健康;
(2)尼古丁是香烟烟雾中的有害物质,其化学式为C10H14N2,其中氮元素的质量分数是 _________ (精确到0.1%);
(3)随意丢弃的烟头可能会引发火灾,熄灭烟头的一种方法是 _________ ,其原理是 _________ ;
(4)煤矿的矿井里含有甲烷,在矿井里吸烟可能引发爆炸,原因是 _________ .
CO是一种无色、无味、有毒的可燃气体污染物,具有还原性,可用于冶金工业。某兴趣小组为探究其具有还原性,设计了如下实验装置。请回答以下有关问题:
①CO气体能使人中毒,其原因是
②实验开始时,先通人CO一段时间后,再加热,其原因是
③实验中图A处玻璃管中发生的现象是 ,其化学反应方程式为
④实验中图B处发生的现象是 ,其化学反应方程式为 。
⑤该装置中有一个明显的缺陷,请指出改正方法
在学习NaOH的性质时,老师将CO2通入盛有NaOH溶液的试管中,同学们没有观察到明显现象。CO2和NaOH发生反应了吗?探究活动从这个疑问开始。
(1)明明同学认为两者发生了反应,他设计了一种方案,如图所示,加入适量NaOH溶液后,他可观察到的小气球的变化是______________,产生这种现象的原因是__________________________,反应的化学方程式是____________________________________________。
(2)另一位同学认为这个方案还不足以证明CO2和NaOH确实发生了反应,因为NaOH溶液中有水,二氧化碳又能溶于水。为使实验方案更完善,你认为还需要做什么实验来探究这个问题?
取两块大小相同的干冰。在干冰中央挖一个小穴,撒入一些镁粉,用红热的铁棒把镁点燃,将另一块干冰盖上,你会看到镁粉在干冰内继续燃烧,发出耀眼的白光,像冰灯一样。已知该反应的生成物是氧化镁和碳。
干冰的化学式为_________;该实验证明干冰具有_____________________________________________的性质(答一条即可);为验证上述反应所得固体中无剩余镁,可向该固体中加入试剂得名称为_________________________,反应的现象是___________________________________。
“对比实验”是化学学习中行之有效的思维方法。某化学学习小组的同学在学完相关的化学知识后,走进实验室做了如下实验,请你参与并回答下列问题。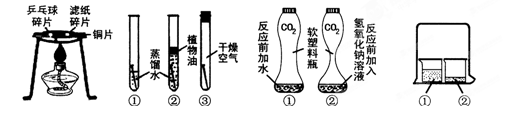
| A.燃烧的条件 | B.铁钉生锈的条件 | C.证明CO2与NaOH反应 | D.分子运动的现象 |
(1)通过实验A,可以说明燃烧的条件之一是 ,实验中使用铜片,是利用了铜的 性(填一条物理性质)。
(2)对于实验B,一段时间后观察到试管①中的铁钉明显锈蚀,由此得出:铁生锈的主要条件是铁与水和 直接接触。若用稀硫酸来除去铁制品表面的铁锈, (填“能”或“不能”)长时间浸在稀硫酸溶液中,理由是 (用化学方程式表示)。
(3)实验C是利用体积相同并充满CO2的软塑料瓶、等量的水(瓶①)和NaOH溶液(瓶②)进行实验,根据塑料瓶变瘪的程度证明CO2与NaOH溶液中的溶质确实发生了反应,这一反应的化学方程式为 。
(4)实验D的烧杯②中呈现的现象能说明分子是不断运动的。当烧杯①中液体是浓氨水时烧杯②中的酚酞溶液由无色变为 色;当烧杯①中液体换成浓盐酸,且烧杯②中液体换成滴有酚酞的NaOH溶液时,一段时间后,溶液颜色的变化是 。其中盐酸与NaOH反应的化学方程式 。
科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环。
(1)步骤1的化学方程式为 。
(2)为确定步骤2中的碳酸钙是否完全分解,设计的实验步骤为:取少量固体于试管中,滴加过量
溶液,若观察到试管内 ,则分解不完全。
(3)上述设想的优点有 (填字母序号)。
a.原料易得且可循环利用
b.充分利用太阳能
c.可全地域全天候使用
(4)CO2是宝贵的碳氧资源.CO2和H2在一定条件下可合成甲酸(HCOOH),此反应中CO2与H2的分子个数比为 ,若要检验1%甲酸水溶液是否显酸性,能选用的有 (填字母序号)。
a.无色酚酞溶液
b.紫色石蕊溶液
c.pH试纸
(5)请列举CO2的另两种用途 , 。
根据图示回答下列问题:
(1)图中,图一是制备某气体的错误装置,请指出图中的主要错处 。图一的装置改错后可用于制备的气体是 。
(2)图中图二的错误是 。
按右图连接好的装置图,在Ⅰ试管中加入几块石灰石和适量稀盐酸,在II试管中装入一定量澄清石灰水,打开止水夹,则可以观察到的现象是 ;反应片刻后夹紧止水夹,此时出现的现象是 ,其原因是 ,有关反应的化学方程式是: ; 。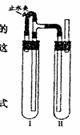
科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环.
(1)步骤1的化学方程式为 .
(2)为确定步骤2中的碳酸钙是否完全分解,设计的实验步骤为:取少量固体于试管中,滴加过量 溶液,若观察到试管内 .则分解不完全.
(3)上述设想的优点有 (填字母序号).
A.原料易得且可循环利用 B.充分利用太阳能 C.可全地域全天候使用
(4)CO2是宝贵的碳氧资源.CO2和H2在一定条件下可合成甲酸(HCOOH),此反应中CO2与H2的分子个数比为 ,若要检验1%甲酸水溶液是否显酸性,能选用的有 (填字母序号).
A.无色酚酞溶液 B.紫色石蕊溶液 C.PH试纸
(5)请列举CO2的另一种用途 它含量过高还容易引起的环境问题
碳元素是组成物质的基本元素,“碳循环”也是自然界重要的循环,根据所学完成下题:
(1)碳元素形成的单质除金刚石、石墨外,还有一种物质的分子类似足球状,这种物质的化学式为________,它们都属于__ ____(选填“有机物”、“无机物”或“单质”)
(2)化石燃料主要包括煤、石油 和天然气,都含有碳元素,其中天然气的主要成分是 (写化学式),其完全燃烧的化学方程式是
(3)CO2常用于灭火,但镁着火不能用 CO2灭火,原因是它们能发生反应,请写出该置换反应的化学方程式 _____
(4)矿石中含碳元素,菱锰矿的成分是碳酸锰( MnCO3),其中锰元素的化合价 。
(5)在 440℃和高压条件下,金属钠与二氧化碳反应能生成金刚石(C)和碳酸钠,该反应的化学方程式为 。
化学小组设计了下图所示的实验装置,可以完成多个实验。
(1)若利用I、Ⅱ装置制取氧气:打开K1、关闭K2时,装置I中发生反应的化学方程式是 。
(2)若利用Ⅰ、Ⅲ装置测定空气中氧气的含量:关闭K、K1、K2,用凸透镜引燃B中的白磷,待冷却后 ,(填某一项实验操作)整个实验过程中的现象是 。
(3)若利用Ⅰ、Ⅲ装置验证二氧化碳的性质:
①若要验证二氧化碳能与水发生反应,应向烧杯的水中加入 ;
②若利用“B中已充满的二氧化碳,并在A中注入氢氧化钠溶液,烧杯中注入稀盐酸”来验证二氧化碳能与氢氧化钠发生反应,其操作及现象是 。
(资料:①二氧化碳与氢氧化钠发生反应,但没有明显现象②生成的碳酸钠也能与稀盐酸反应产生二氧化碳)