某白色固体甲,可能含有硫酸钠、氢氧化钠、碳酸钠、氯化钠中的一种或几种;某无色溶液乙是初中化学常见的一种可溶性钡盐溶液。为探究白色固体甲的成分,进行如下实验。对于固体甲的分析错误的是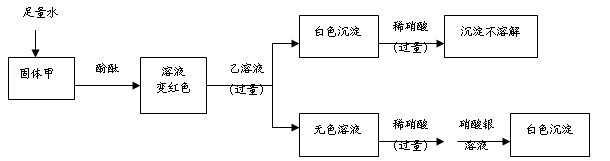
| A.一定有硫酸钠 |
| B.一定有氢氧化钠 |
| C.若乙溶液为硝酸钡溶液,一定有氯化钠 |
| D.至少含有碳酸钠、氢氧化钠中的一种 |
构建知识网络是一种重要的学习方法,下面是某同学整理的关于碳酸钠化学性质的知识网络,能相互反应的物质之间用短线“﹣”表示,通过一步反应能直接转化的两种物质之前和箭号“→”表示(从反应物指向生成物).A、B属于不同类别的化合物.
请填写下列横线:
(1)该同学将A物质的溶液滴加到碳酸钠溶液中,观察到有无色气泡冒出,则A物质可能是 (填写一种物质的化学式).
(2)该同学归纳了,能够与碳酸钠溶液反应生成白色沉淀的B物质有多种,请选取其中一种,写出其与碳酸钠溶液反应的化学方程式 ;除你选取的物质所属类别外,B物质还可能属于 (填写物质类别).
(3)知识网络总是在不断的补充完善,该同学发现,有一种物质既能与碳酸钠发生双向转化,又能与硫酸钠发生双向转化,这种物质是 (填写化学式).
实验室现有两包样品,各取少量分别溶于水得甲、乙两种溶液,它们中的溶质是由KNO3、Fe(NO3)3、Fe2(SO4)3、NaNO3、NaOH、Na2SO4中的一种或几种组成,为了确定其组成,某同学进行了如图所示的实验。(假设每步反应都恰好完全反应)
试推断:
(1)A是 ,溶液甲中一定不含的溶质是 。.
(2)若溶液甲中不只一种溶质,则溶液乙中的溶质有 种可能的组成。(填一数字)
(3)若溶液丁是纯净的NaCl溶液,则向溶液丙中只要加入 溶液即可。
现欲探究一固体粉末状混合物A的成分,已知其中可能含有CuSO4、BaCO3、NH4NO3、Fe2O3、NaCl五种物质中的两种或多种。按下图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应)。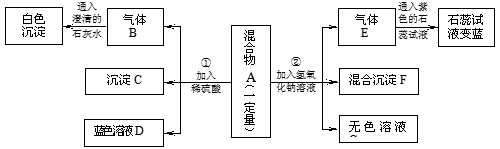
试根据实验过程和出现的现象做出判断,填写以下空白:
(1)①沉淀C的化学式为 , ②气体E的化学式为
(2)在混合物A中,肯定不存在的物质是 (写化学式)
(3)在混合物A中,肯定存在的物质是 (写化学式)
(4)溶液D中一定存在的金属阳离子为 (写离子符号)
(5)写出实验过程②中肯定发生的一个反应化学方程式:
下列用字母表示的八种物质是初中化学常见的物质,它们是由H、C、O、S、
Ca、Fe、Cu七种元素中的一种或两种组成。
(1)A、B、C三种物质之间可以发生两个反应:A+B→C,C→A+B。其中A是最清洁的燃料,请写出C→A+B反应的化学方程式 。
(2)D的一种单质在B中燃烧生成一种无色无味气体E,将该气体通入紫色石蕊溶液中,溶液变为红色,请用化学方程式表示石蕊溶液由紫色变为红色的原因 。
(3)F与某红色氧化物在一定条件下反应生成X和E,F和E元素组成相同。该反应的化学方程式为 。
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO等,工艺流程图如下:
【查阅资料】①一般情况下,难溶性碱受热易分解,生成对应的金属氧化物和水;
②Mg(OH)2和Zn(OH)2开始沉淀和沉淀完全时的pH如下表所示:
| |
Mg(OH)2 |
Zn(OH)2 |
| 开始沉淀的pH |
10.4 |
6.4 |
| 沉淀完全的pH |
12.4 |
8.0 |
| 开始溶解的pH |
—— |
10.5 |
根据上图回答下列问题:
(1)将菱锌矿研磨成粉的目的是 ;
(2)针铁矿的组成元素是Fe、O和H,相对分子质量是89,针铁矿中铁原子数︰氧原子数︰氢原子数= ;(提示:氢原子数目小于氧原子数目)
(3)“滤液4”之前加入锌粉的目的是 ;
(4)工业上从“滤液3”制取MgO过程中,合适的反应物是 (选填序号);
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(5)完成这个流程中发生的化学反应方程式:
4Fe(OH)2+Ca(ClO)2+2 =4Fe(OH)3+CaCl2,
(5分)下图中的A~G是初中化学常见的纯净物,且均含有一种相同的元素。其中A的饱和溶液加热后会变浑浊,B、C是氧化物;E是发酵粉的主要成分,E、G分别与足量F反应的生成物相同。图中“一”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物或生成物已略去。
(1)写出C的化学式
(2)在B和C的混合物中滴加无色酚酞溶液,酚酞溶液显
(3)写出F和D反应的化学方程式
(4)写出G的一种用途
一包白色粉末可能有CaCO3、K2SO4、CuSO4、BaCl2、K2CO3的一种或几种,现在进行如下实验。其中说法错误的是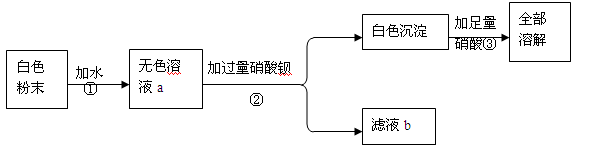
| A.由操作①可知:白色粉末中一定没有CaCO3、CuSO4 |
| B.由操作②可知:白色粉末中一定没有BaCl2 |
| C.由操作③可知:白色粉末中一定有K2CO3可能有K2SO4 |
| D.滤液b中的溶质有2种 |
(5分)金属元素在生活、生产中,以及对人类的健康有着很重要的作用.用金属铁制备自来水的新型消毒、净水剂K2FeO4的流程如图
请回答下列问题:
(1)固体B的成分是______________,反应a的化学方程式为:____________________.
(2)操作I的名称是_____________;操作I所需要的仪器和用品:铁架台、玻璃仪器、试剂、_______(填一种实验物品名称).
(3)反应a、b、c中没有涉及到的化学反应类型是___________(填字母代号).
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应. |
(8分)甲、乙、丙、丁、戊分别是稀硫酸、镁、氢氧化钠溶液、氧化镁及硫酸铜溶液中的一种。下图反映了它们之间的相互关系。其中“一”表示相连的物质间可以相互反应,“→”表示甲在一定条件下可以转化为戊。已知丁溶液呈蓝色。请回答以下问题:
(1)写出下列物质(或溶质)的化学式:
甲 、戊 。
(2)图中各反应不含有四种基本反应类型中的 反应。
(3)写出下列反应的化学方程式:
乙与丙: 。
丙与丁: 。
(4)例举丙在生产、生活中的一种用途: 。
某样品中可能含有硫酸铜、碳酸钠、硝酸钾或硝酸钡四种中的一种或几种。现将样品加入足量的水得到无色溶液,再往溶液中加入过量的氯化钙溶液,得到白色沉淀,对样品中的组成判断合理的是
| A.肯定含有硝酸钾,可能含有硝酸钡 |
| B.肯定含有碳酸钠,可能含有硝酸钡 |
| C.不含硫酸铜和硝酸钡,只含碳酸钠 |
| D.肯定含有碳酸钠,可能含有硝酸钾 |
下列图像与所述实验相符的是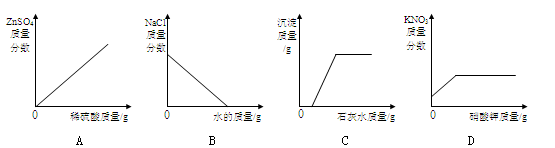
| A.向一定量锌粒中加入过量稀硫酸 |
| B.向一定量氯化钠饱和溶液中不断加水 |
| C.向一定量氢氧化钠和碳酸钠的混合溶液中加入过量的石灰水 |
| D.20℃时,向一定量不饱和的硝酸钾溶液中加入过量的硝酸钾晶体 |
盐城濒临黄海,海盐文化全国知名.某兴趣小组同学去盐场参观,带回了部分粗盐样品,并对其进行了如下探究:
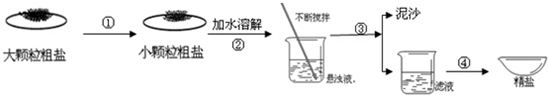
(1)操作①中必须用到的一种仪器是(填序号)
| A. | 研钵 | B. | 量筒 | C. | 烧杯 | D. | 试管 |
(2)操作③的名称是,操作④中用到玻璃棒,作用为.
(3)用提纯得到的"精盐"配制100g 7.5%的氯化钠溶液.经检测,溶质质量分数偏小,其原因可能有(填序号)
①氯化钠固体不纯
②称量时精盐与砝码放反了
③量取水时俯视读数
④装瓶时,有少量溶液洒出
(4)查阅资料得知:粗盐中除含少量泥沙等不溶性杂质外,还含有少量的可溶性杂质(假定可溶性杂质只有
一种),为了得到较纯净的氯化钠,小组同学将所得的"精盐"又作了如下处理:
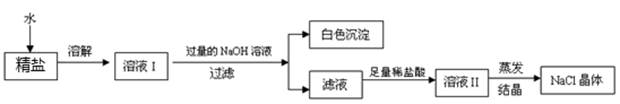
①白色沉淀的化学式为.
②在得到的滤液中加入足量的稀盐酸的目的是.
③若实验过程中不考虑损耗,最终到的
固体的质量将(填"大于"、"小于"或"等于")原精盐中
的质量.
如图所示,其中甲、乙、丙、丁、戊分别是铁、盐酸、氢氧化钙、二氧化碳、碳酸钠中的一种.图中相连的两圆表示相应物质能发生反应,已知乙是铁.下列说法错误的是()
| A. | 五种物质中,只有铁是单质 | B. | 丙是盐酸 |
| C. | 戊是氢氧化钙 | D. | 甲与丁反应属于复分解反应 |
A、B、C、D是初中化学常见的物质,其中A为无色气体单质,B、C为氧化物,且B为有毒气体,D是大理石的主要成分,它们之间的转化关系如下图所示(图中反应条件及部分反应物、生成物已省略)。
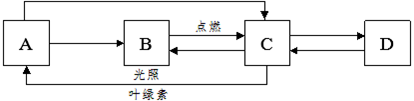
回答下列问题:
(1)写出下列物质的化学式:A ;B ;C 。
(2)实验室常用 鉴别B和C。
(3)写出由物质C转化为物质B的化学方程式 。
(4)写出物质C与过氧化钠(Na2O2)反应生成碳酸钠和物质A的化学方程式 。