海洋是一个巨大的资源宝库,海水中有大量可以利用的化学资源,例如氯化镁、氯化钠、溴化钠等.如图为综合利用海水制备金属镁的流程.
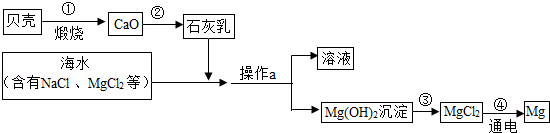
该流程中没有涉及的化学反应是( )
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
下列图像不能正确反映其对应变化关系的是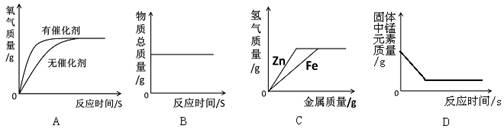
| A.用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制氧气 |
| B.一定质量的红磷在密闭容器中燃烧 |
| C.向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 |
| D.加热一定量高锰酸钾制氧气 |
造纸是我国古代四大发明之一,它极大地推动了人类文明的发展。
(1)践行“习近平生态文明思想”,应积极推广垃圾分类和回收利用。旧报纸应投放到贴有如图 (填字母)标签的垃圾筒内。

6105n,n为正整数]中H、O两种元素的质量比为 (用最简整数比表示)。
(3)造纸会产生大量含NaOH的废水,需处理至中性后排放。环保监测小组取某造纸厂废水样品过滤,为测定滤液中NaOH的质量分数,进行了如下实验:
步骤1:取20.0g滤液于锥形瓶中,滴入几滴酚酞溶液。
步骤2:向锥形瓶中逐滴滴加溶质质量分数为10.0%的硫酸溶液至溶液呈中性,此时溶液呈 色。消耗硫酸溶液3.92g。
计算废水滤液中NaOH的质量分数。(请写出计算过程)
如右图所示,打开止水夹,将液体A滴入试管②中与固体B接触,若试管①中的导管口有气泡产生,则液体A和固体B的组合不可能是
| A.稀盐酸和锌粒 | B.过氧化氢溶液和二氧化锰 |
| C.水和氢氧化钠 | D.水和硝酸铵 |
火星大气中含有一种称为硫化羰(羰音tāng)的物质,其化学式为COS。已知硫化羰与二氧化碳的结构相似,但能在氧气中燃烧,下列有关硫化羰的说法正确的是
| A.硫化羰是氧化物 |
| B.硫化羰的化学性质与二氧化碳的化学性质完全相同 |
| C.硫化羰可用作灭火剂 |
| D.硫化羰是由碳元素、氧元素和硫元素三种元素组成的 |
有A、B、C、D、E五种物质,在常温下A、B是液体,C是气体,D是黑色固体,E是一种能使澄清石灰水变浑浊的气体;A和B的组成元素相同,图中“→”表示物质间存在转化关系,部分反应物、生成物及反应条件已略去。
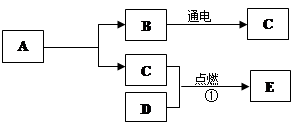
(1)写出B、E的化学式: B ,E ;
(2)A和C内含有的同一种元素名称是 ;
(3)写出①反应的文字表达式 。
科学兴趣小组在调查一化工厂时,发现有个车间排出的废水澄清透明,呈黄色.为测定该废水中所含的物质,他们进行如下实验(假设能发生的反应均恰好完全反应):
(1)用pH试纸测试,测得pH为2.
(2)取一定量废水溶液,加入Ba(NO3)2溶液,无现象.
(3)另取一定量废水溶液,加入AgNO3溶液后,过滤,得到白色沉淀A和滤液.
(4)向滤液中加入NaOH溶液,得到红褐色沉淀B.
由此可知:该废水溶液呈 性;所得的红褐色沉淀B为 ;废水溶液中肯定含有的盐是 .
新冠疫情发生以来,在“坚定信心、同舟共济、科学防治、精准施策”的思想指引下,中国抗疫取得重大胜利!
(1)对新型冠状病毒的毒株分离和基因测序,是研发疫苗和药物的基础。为应对疫情,同学们都居家学习,在此期间做法合理的有 。
A.健康饮食,平衡膳食
B.长时间躺床上看书
C.多服用抗生素增强抵抗力
D.关爱家人,乐观面对生活
(2)佩戴口罩出行是预防新冠肺炎的重要举措。一次性口罩需要及时更换,废弃的口罩应放入 垃圾桶最合适。
(3)对公共场所的定期消毒是控制新冠肺炎的有力保障。“84”消毒液被广泛用于新冠疫情的卫生消毒,可通过氯气与氢氧化钠反应制取,生成物中有氯化钠、次氯酸钠(NaClO) 和水,其中次氯酸钠是消毒液的有效成分。
①次氯酸钠中氯元素的化合价为 。
②写出制取“84”消毒液的化学方程式 。

酸奶作为世界公认的长寿食品之一正愈来愈受到人们的重视和喜爱。酸奶中的酸味来自乳酸(化学式为C3H6O3)。
(1)酸奶主要提供人类营养物质中的哪一类? 。乳酸在人体内可被完全氧化为CO2和H2O,1.8 g乳酸完全氧化消耗O2的质量为 g。
(2)为了测定某品牌酸奶中乳酸的含量,振华同学取100 mL酸奶和100 mL蒸馏水于烧杯中,慢慢滴入0.4%的 NaOH溶液并不断搅拌,用传感器测得溶液pH随加入NaOH溶液体积V的变化关系如图所示。计算该酸奶中乳酸的含量为多少克每升。
(已知:乳酸的钠盐可表示为CH3CH(OH)COONa,测定所用NaOH溶液的密度为1.0 g/mL,计算结果精确到0.01,无计算过程不给分)。

造纸是我国古代四大发明之一,它极大地推动了人类文明的发展。
(1)践行“习近平生态文明思想”,应积极推广垃圾分类和回收利用。旧报纸应投放到贴有如图 (填字母)标签的垃圾筒内。

(2)为增强纸张的耐磨性,可用玉米淀粉对纸张进行施胶处理。玉米淀粉[(C6H10O5)n,n为正整数]中H、O两种元素的质量比为 (用最简整数比表示)。
(3)造纸会产生大量含NaOH的废水,需处理至中性后排放。环保监测小组取某造纸厂废水样品过滤,为测定滤液中NaOH的质量分数,进行了如下实验:
步骤1:取20.0g滤液于锥形瓶中,滴入几滴酚酞溶液。
步骤2:向锥形瓶中逐滴滴加溶质质量分数为10.0%的硫酸溶液至溶液呈中性,此时溶液呈 色。消耗硫酸溶液3.92g。
计算废水滤液中NaOH的质量分数。(请写出计算过程)
重结晶后的食盐中往往还含有少量的硫酸钠、氯化镁、氯化钙等杂质,它们在溶液中主要以SO2﹣4、Ca2+、Mg2+的形式存在,为将这些杂质除净,可向食盐溶液中加入过量的氢氧化钠、碳酸钠、氯化钡溶液,然后加入盐酸调至溶液pH=7,最后经过过滤、蒸发得到精盐.下列操作及加入溶液顺序错误的是( )
| A.BaCl2、NaOH、Na2CO3、过滤、HCl |
| B.BaCl2、Na2CO3、NaOH、过滤、HCl |
| C.NaOH、BaCl2、Na2CO3、过滤、HCl |
| D.Na2CO3、BaCl2、NaOH、过滤、HCl |
请根据下图回答问题:

① 将图1和图6连接可以制取氧气,反应的化学方程式为 ,证明氧气已经集满的现象是 。若用图6收集一瓶含1/4空气的氧气,操作的方法是 。
② 图2中仪器A的名称为 ,它在装置中的主要作用是 。甲同学用图2和图 连接来制取二氧化碳,装置中加入盐酸的量至少要 。
③ 乙同学在图2基础上增加了一块带孔的隔板(如图3),则大理石应放在 处(填“a”或“b”),该装置中加入盐酸的量至少要 ;若加入盐酸过多,则有可能产生的后果是 ,要使反应停止,其操作是 。
④ 丙同学用过氧化氢溶液和二氧化锰制取氧气,反应的化学方程式为 。反应前他事先往试管中加入了少量的水,甲同学由此产生了疑问,提出了猜想:
猜想1:加水可以起到稀释的作用,使反应速度变缓。
猜想2:……
甲同学根据猜想进行了实验:每次取15mL 15%的过氧化氢溶液,稀释成不同溶质
质量分数,在其他条件相同的情况下进行实验。记录数据如下:
| 实 验 |
1 |
2 |
3 |
4 |
5 |
| 过氧化氢溶液溶质质量分数 |
1% |
3% |
5% |
10% |
15% |
| MnO2粉末用量/g |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
| 收集到500mL气体时所用时间/s |
560 |
186 |
103 |
35 |
12 |
| 反应后液体温度/℃ |
26 |
38 |
43 |
59 |
71 |
根据表中数据可知:过氧化氢溶液的溶质质量分数对反应速度的影响是 。
甲同学的猜想2是:加水可以 。