新冠疫情发生以来,在“坚定信心、同舟共济、科学防治、精准施策”的思想指引下,中国抗疫取得重大胜利!
(1)对新型冠状病毒的毒株分离和基因测序,是研发疫苗和药物的基础。为应对疫情,同学们都居家学习,在此期间做法合理的有 。
A.健康饮食,平衡膳食
B.长时间躺床上看书
C.多服用抗生素增强抵抗力
D.关爱家人,乐观面对生活
(2)佩戴口罩出行是预防新冠肺炎的重要举措。一次性口罩需要及时更换,废弃的口罩应放入 垃圾桶最合适。
(3)对公共场所的定期消毒是控制新冠肺炎的有力保障。“84”消毒液被广泛用于新冠疫情的卫生消毒,可通过氯气与氢氧化钠反应制取,生成物中有氯化钠、次氯酸钠(NaClO) 和水,其中次氯酸钠是消毒液的有效成分。
①次氯酸钠中氯元素的化合价为 。
②写出制取“84”消毒液的化学方程式 。

我国塑料购物袋的年消耗量很大,废弃塑料的处理亟待解决。回答下列问题。
(1)购物袋等塑料制品的大量使用,可能会造成的一种环境污染是 。
(2)小林尝试用焚烧法对某类塑料购物袋(主要成分是聚氯乙烯)进行处理,并将燃烧产物用氢氧化钠溶液进行吸收。
【查阅资料】Ⅰ.聚氯乙烯的化学式为(C2H3Cl)n。
Ⅱ.氯化氢气体会污染环境
Ⅲ.Na2CO3+CaCl2═CaCO3↓+2NaCl
①聚氯乙烯完全燃烧的化学方程式如下:
2(C2H3Cl)n+5nO2 4nCO2+2nHCl+2nX,则X的化学式为 。
②将完全燃烧后的产物,全部通入到一定量的NaOH溶液中,得到吸收液,写出氢氧化钠溶液吸收氯化氢的化学方程式 。
③小林对吸收液的溶质成分产生了兴趣,进行如下探究:
[提出问题]吸收液中溶质的成分是什么?
[进行实验1]取吸收液少许置于试管中,滴加2~3滴无色酚酞试液,发现酚酞变红色,说明溶液呈 性。
[猜想]猜想1:NaCl、NaOH、Na2CO3
猜想2:
猜想3:NaCl、Na2CO3、NaHCO3
猜想4:NaCl、NaHCO3
[进行实验2]向实验1所得溶液中,加入过量的CaCl2溶液,小林观察到 (填实验现象),最终得出结论:猜想1正确。
[交流反思]实验结束后,小林对吸收液进行无害化处理,其方案是 ,然后倒入废液缸。
咨询老师后,小林获悉废弃塑料的资源化回收是减少环境危害的最好方法。
(3)聚氯乙烯的生产需要用到氯气。工业上获取氯气的方法是电解饱和食盐水,发生反应的化学方程式为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑.某工厂需生产14.2t氯气(Cl2),至少需要氯化钠的质量为多少?(请写出计算过程)
酸奶作为世界公认的长寿食品之一正愈来愈受到人们的重视和喜爱。酸奶中的酸味来自乳酸(化学式为C3H6O3)。
(1)酸奶主要提供人类营养物质中的哪一类? 。乳酸在人体内可被完全氧化为CO2和H2O,1.8 g乳酸完全氧化消耗O2的质量为 g。
(2)为了测定某品牌酸奶中乳酸的含量,振华同学取100 mL酸奶和100 mL蒸馏水于烧杯中,慢慢滴入0.4%的 NaOH溶液并不断搅拌,用传感器测得溶液pH随加入NaOH溶液体积V的变化关系如图所示。计算该酸奶中乳酸的含量为多少克每升。
(已知:乳酸的钠盐可表示为CH3CH(OH)COONa,测定所用NaOH溶液的密度为1.0 g/mL,计算结果精确到0.01,无计算过程不给分)。

金属及其化合物在生产生活中有广泛的应用。

(一)金属的应用和防护
(1)用不锈钢、合成橡胶、氧化镁等材料制造的飞机轮胎属于 材料。
(2)航空煤油是飞机的燃料,它主要是由 炼制的。
(3)铁易生锈,提出防止铁生锈的一种方法 。
(4)特种钢中含有少量Mn、MnO2和Al粉混合在高温下反应可得到Mn,该反应的化学方程式为 。
(5)Mg(OH)2受热分解生成高熔点的MgO.Mg(OH)2可用作阻燃剂,其主要原理是 (选填序号)。
a.分解吸热,降低可燃物着火点 b.MgO覆盖燃烧物,隔绝氧气
(二)制备还原性铁粉
实验室利用废铁屑(含少量Fe2O3)为原料制备还原性铁粉的流程如下:
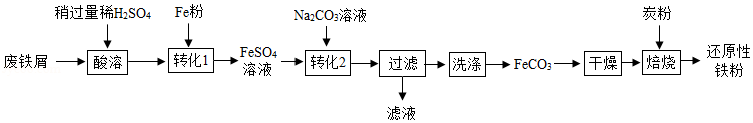
(1)Fe粉可使“酸溶”产生的Fe2(SO4)3转化为FeSO4,该反应的化学方程式为 。
(2)检验FeCO3已洗净的方法:取最后一次洗涤后的滤液,先加入一定量稀盐酸,再滴加 溶液,无明显现象。
(3)“干燥”时有少量FeCO3发生下列转化:FeCO3 FeOOH+CO2,该转化的化学方程式为 。
(4)“焙烧”前,应将炭粉与“干燥”所得固体均匀混合,目的是 。
(三)测定还原性铁粉的组成
还原性铁粉中含有少量FexCy,小组同学在老师的指导下进行以下实验。
资料:①Fe,FexCy在加热时与O2反应能生成相应氧化物。
②FexCy不与酸反应。
实验1:取29.52g样品,加入足量稀H2SO4,充分反应后生成1.00gH2。
实验2:另取29.52g样品,按如图进行实验。
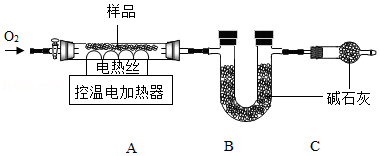
表:装置A和B的质量变化
装置 |
A |
B |
反应前 |
300.00 |
400.00 |
反应后 |
m |
400.44 |
实验后A中固体全部变为红棕色,装置A、B的质量变化如上表。
(1)装配好装置后,实验前先要 。
(2)装置C的作用是 。
(3)FexCy中,x:y= 。表中m的值是 。
反思:若用空气替代O2进行实验,测得x:y的值偏大,可能的原因是 。
2019年春节起,常州大部分地区禁止燃放烟花爆竹,开启了龙城环保新时代。
(1)“禁止燃放烟花爆竹”的安全标志是 。

(2)禁止燃放烟花爆竹不仅可以减少噪声污染、火灾等,还以减少SO2和 等空气污染物的排放,提升空气质量。
(3)爆竹中常含有硫、硝酸钾和木炭的混合粉末,点燃后生成硫化钾(K2S)、氮气和二氧化碳,该反应的化学方程式为 。含硫燃料燃烧产生的SO2会形成 型酸雨,酸雨的pH (填序号)。
A.小于5.6 B.等于7 C.大于7
下列说法中不正确的是( )
A.通过燃烧法区分羊毛织物和棉织物
B.生成盐和水的反应不一定是中和反应
C.用水灭火的原理是降低可燃物的着火点
D.垃圾通过集中无害化发电处理,可减少环境污染
造纸是我国古代四大发明之一,它极大地推动了人类文明的发展。
(1)践行“习近平生态文明思想”,应积极推广垃圾分类和回收利用。旧报纸应投放到贴有如图 (填字母)标签的垃圾筒内。

(2)为增强纸张的耐磨性,可用玉米淀粉对纸张进行施胶处理。玉米淀粉[(C6H10O5)n,n为正整数]中H、O两种元素的质量比为 (用最简整数比表示)。
(3)造纸会产生大量含NaOH的废水,需处理至中性后排放。环保监测小组取某造纸厂废水样品过滤,为测定滤液中NaOH的质量分数,进行了如下实验:
步骤1:取20.0g滤液于锥形瓶中,滴入几滴酚酞溶液。
步骤2:向锥形瓶中逐滴滴加溶质质量分数为10.0%的硫酸溶液至溶液呈中性,此时溶液呈 色。消耗硫酸溶液3.92g。
计算废水滤液中NaOH的质量分数。(请写出计算过程)
造纸是我国古代四大发明之一,它极大地推动了人类文明的发展。
(1)践行“习近平生态文明思想”,应积极推广垃圾分类和回收利用。旧报纸应投放到贴有如图 (填字母)标签的垃圾筒内。

6105n,n为正整数]中H、O两种元素的质量比为 (用最简整数比表示)。
(3)造纸会产生大量含NaOH的废水,需处理至中性后排放。环保监测小组取某造纸厂废水样品过滤,为测定滤液中NaOH的质量分数,进行了如下实验:
步骤1:取20.0g滤液于锥形瓶中,滴入几滴酚酞溶液。
步骤2:向锥形瓶中逐滴滴加溶质质量分数为10.0%的硫酸溶液至溶液呈中性,此时溶液呈 色。消耗硫酸溶液3.92g。
计算废水滤液中NaOH的质量分数。(请写出计算过程)
水是由氢、氧两种元素组成的化合物。这一结论是科学家们在大量实险的基础上得出的。
(1)实验室中常用锌粒和稀硫酸反应来制备氢气。请从图1装置中选择并组装一套制取干燥氢气的装置,正确的连接顺序为 (用接口处字母填写)。

(2)研究氢气的燃烧实验是人们认识水组成的开始。
①氢气在点燃前一定要 。
②氢气在空气中燃烧时,若在火焰上方罩一冷而干燥的小烧杯,可观察到的现象是 。在相同条件下,欲使1L氢气完全燃烧,所需空气至少约为 L。
(3)科学家们又用“电解法”证明了水的组成(装置如图2所示,电极不与水及生成的气体反应)。电解时,水中需加入少量的NaOH,其作用是 。 通电一段时间后,发现甲、乙两量筒中收集的气体体积比略小于1:2,其原因可能是 (写出一条即可)。
(4)拉瓦锡还用另一实验证明了水的组成。
他让水蒸气通过一根烧红的铁质枪管,结果得到了氢气,同时枪管表面有黑色固体(磁铁矿的主要成分)生成。该反应的化学方程式为 。
(5)用“氢气还原氧化铜”实验也可以证明水的组成(图3)。装置A中的玻璃管和其中物质在反应前后的质量差为m1,装置B和其中物质在反应前后的质量差为m2,据此可计算出水中O、H元素的质量比为 (用含 m1、m2的代数式表示)。实验时该比值往往略小于8:1,原因可能是 (写出一条即可)。
(6)碘与锌在常温下反应速度很慢,若滴入几滴水则反应剧烈,水在此的作用是 。
化学是以实验为基础的科学,实验是科学探究的重要手段。
(1)某化学兴趣小组的同学利用下图微型实验装置进行探究实验。

①写出一个双球管中可能反应的化学方程式。
②挤压右滴管并微热燃烧管,白磷燃烧而红磷不燃烧,由此可说明燃烧需要什么条件?
③相同质量的磷、铁、镁分别在氧气中完全燃烧,消耗氧气最多的是 。
(2)实验室可利用如图实验装置制取纯净、干燥的CO,然后用CO还原Fe2O3并检验气体产物。已知CO发生装置中的反应为:H2C2O4 H2O+CO2↑+CO↑
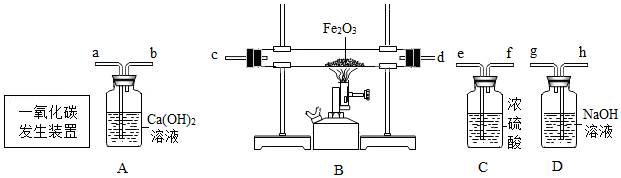
①A装置中能观察到什么现象?
②写出B装置中反应的化学方程式。
③要达到实验目的,装置中导管接口从左到右的连接顺序为: 一氧化碳发生装置接 、 接 、 接 、 接 。
④从环保角度考虑,还需对以上装置进行改进,请简述改进措施。
(3)将30.9g 氯酸钾(KClO3)和二氧化锰的固体混合物装入试管中,加热制取氧气,同时生成氯化钾。待反应完全后,将试管冷却,称量,可以得到21.3g 固体物质。请计算原固体混合物中氯酸钾的质量。
实验是科学探究的重要途径。
(1)某同学利用如图1微型装置进行实验探究。请回答:
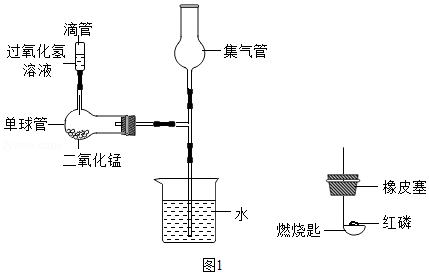
单球管中发生反应的化学方程式是 ;制取的气体收集在集气管中,将红磷在酒精灯上加热后迅速放进集气管,塞紧塞子,观察到的现象是 ,反应的化学方程式为 。
(2)实验室选用如图所示装置制取纯净、干燥的CO2,并验证其部分性质。

①B装置中发生反应的化学方程式为 。
②C装置中浓硫酸的作用是 。
③请在D中简要补画出CO2的收集装置图。
④要证明在E装置中CO2与NaOH溶液发生了反应,应选用的试剂是 。
(3)取12.5g石灰石于装置A中,向其中加入100g足量的稀盐酸,充分反应后(杂质不参加反应),A中固液混合物的质量为108.1g,请计算该石灰石中碳酸钙的质量分数。
今年5月,运用"蓝鲸一号"钻探平台,我国南海神狐海域首次实现可燃冰试采成功.
材料一:可燃冰、学名天然气水化合物,其化学式为CH 4•8H 2O.它是天然气的固体状态(因海底高压).埋于海底地层深处的大量有机质在细菌的分解作用下,最后形成石油和天然气(石油气),其中许多天然气被包进水分子中,在海底的低温(2~5℃)与压力下结晶,形成"可燃冰".
材料二:"蓝鲸一号"钻探平台设计和建造过程刷新了多项世界纪录,它长117米,宽92.7米,高118米,质量为42000吨.
请根据上述材料回答:
(1)形成可燃冰需要一定的生态环境.
①海底地层深处,这些分解有机质的细菌能很好的生存,体现了生物对环境的 .这些细菌分解有机质 (选填"需要"或"不需要")氧气,这些细菌与真菌在细胞结构上的主要区别是 .
②在开采过程中,极少量的垃圾废弃物没有对海洋环境造成破坏,这主要是因为海洋生态系统有 的能力.
(2)形成可燃冰的其中一个条件是有甲烷气源.
①可燃冰(CH 4•8H 2O)中C:H:O的元素质量比是 ,甲烷属于 (选填"有机物"或"无机物").
②与石油、煤等化石燃料相比较,开采可燃冰的积极意义有(写一条) .(可燃冰在空气中燃烧的化学方程式为CH 4•8H 2O+2O 2  CO 2+10H 2O)
CO 2+10H 2O)
(3)如果南海海水的密度是1.03×10 3千克/米 3,"蓝鲸一号"钻探平台漂浮海面受到海水浮力是 牛,浸入海水的体积至少需要 米 3,开采出的可燃冰可以直接在管口点燃,说明已经成为气体,从固体变成气体的原因可能是 .
铜、铁是人类使用最早、应用广泛的金属.
(一)对古代制品的认识
青铜铸件、丝绸织品、陶瓷器皿是我国古代劳动人民创造的辉煌成就.
1、上述制品不涉及到的材料是 (选填序号).
A、金属材料 B、无机非金属材料 C、复合材料
2、如图1为出土文物古代青铜铸件"马踏飞燕".该文物能保存至今的原因可能是 (选填序号).
A、铜的活泼性弱 B、铜不会生锈 C、深埋于地下,隔绝空气
(二)铁、铜的冶炼
1、我国古代曾用孔雀石炼铜,涉及主要反应的化学方程式: ,2CuO+C  2Cu+CO 2↑.
2Cu+CO 2↑.
2、铁、铜矿石有赤铁矿(Fe 2O 3)、磁铁矿(Fe 3O 4)、黄铁矿(FeS 2)、黄铜矿(CuFeS 2)等.CuFeS 2为二硫化亚铁铜,其中S元素的化合价为 .
(1)工业炼铁大多采用赤铁矿、磁铁矿.以磁铁矿为原料炼铁反应的化学方程式为 .炼铁不采用黄铁矿、黄铜矿,可能的原因是:
①黄铁矿、黄铜矿含铁量相对低;② .
(2)以黄铜矿为原料,采用生物炼铜是现代炼铜的新工艺,原理为:4CuFeS 2+17O 2+2H 2SO 4  4CuSO 4+2Fe 2(SO 4) 3+2H 2O.
4CuSO 4+2Fe 2(SO 4) 3+2H 2O.
向上述反应后的溶液中加入Fe粉,得到FeSO 4溶液和Cu.
①发生主要反应的化学方程式:Fe+Fe 2(SO 4) 3=3FeSO 4, .
②FeSO 4溶液经蒸发浓缩、 、过滤等操作得到FeSO 4•7H 2O晶体.
(三)黄铜矿中铁、铜含量的测定
在科研人员指导下,兴趣小组称取25.00g黄铜矿(含少量Fe 2O 3和其它不含金属元素的杂质)模拟生物炼铜,使其全部转化为CuSO 4、Fe 2(SO 4) 3溶液.向溶液中加入过量NaOH溶液得到Cu(OH) 2、Fe(OH) 3固体.
1、证明NaOH溶液过量的方法:静置,向上层清液中滴加 溶液,无现象.
2、用图2装置对固体进行热分解实验.
【资料】
①在68℃时,Cu(OH) 2分解为CuO;在500℃时,Fe(OH) 3分解为Fe 2O 3.
②在1400℃时,CuO分解为Cu 2O和O 2,Fe 2O 3分解为复杂的铁的氧化物和O 2.
(1)装配好实验装置后,先要 .
(2)停止加热后仍需继续通N 2,可防止倒吸和 .
(3)控制不同的温度对A中固体加热,测得装置B和C中铜网的质量变化如表.
| 温度/℃ |
室温 |
100 |
550 |
1400 |
| B装置/g |
200.00 |
201.80 |
205.04 |
205.04 |
| C中铜网/g |
100.00 |
100.00 |
100.00 |
101.28 |
①此黄铜矿中铜、铁元素的质量分数:ω(Cu)%= ;ω(Fe)%= .
②复杂的铁的氧化物化学式为 .

化学课后,化学兴趣小组的同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究:
【提出问题1】该氢氧化钠溶液是否变质了呢?
【实验探究1】
| 实验操作 |
实验现象 |
实验结论 |
| 取少量该溶液于试管中,向溶液中滴加 , 并不断振荡. |
有 产生. |
氢氧化钠溶液一定变质了. |
【提出问题2】该氢氧化钠溶液是全部变质还是部分变质呢?
【猜想与假设】
猜想1:氢氧化钠溶液部分变质.
猜想2:氢氧化钠溶液全部变质.
【查阅资料】
(1)氯化钙溶液呈中性.
(2)氯化钙溶液能与碳酸钠溶液反应:CaCl2+Na2CO3=CaCO3↓+2NaCl
【实验探究2】
| 实验步骤 |
实验现象 |
实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量的 溶液,并不断振荡. |
有 生成. |
说明原溶液中一定有碳酸钠. |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液. |
溶液变红色. |
说明原溶液中一定有 . |
【实验结论】该氢氧化钠溶液 (填“部分”或“全部”)变质.
【反思与评价】
(1)氢氧化钠溶液露置于空气中容易变质,请写出相关反应的化学方程式: .
(2)在上述[实验探究2]中,小明提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案 (填“可行”或“不可行”).
重结晶后的食盐中往往还含有少量的硫酸钠、氯化镁、氯化钙等杂质,它们在溶液中主要以SO2﹣4、Ca2+、Mg2+的形式存在,为将这些杂质除净,可向食盐溶液中加入过量的氢氧化钠、碳酸钠、氯化钡溶液,然后加入盐酸调至溶液pH=7,最后经过过滤、蒸发得到精盐.下列操作及加入溶液顺序错误的是( )
| A.BaCl2、NaOH、Na2CO3、过滤、HCl |
| B.BaCl2、Na2CO3、NaOH、过滤、HCl |
| C.NaOH、BaCl2、Na2CO3、过滤、HCl |
| D.Na2CO3、BaCl2、NaOH、过滤、HCl |