有四瓶无色溶液,它们分别是:①稀盐酸 ②稀硫酸 ③氢氧化钠溶液 ④硫酸钠溶液。某实验小组分别对四种溶液进行了一系列实验,结果如表:
则对应甲、乙、丙、丁顺序的四种物质是( )
| A.②③④① | B.④③②① | C.③④①② | D.①②④③ |
下列物质分别能与稀盐酸、稀硫酸、氯化铜溶液反应并观察到不同实验现象的是( )
| A.氯化钾溶液 | B.碳酸钠溶液 |
| C.硝酸钡溶液 | D.氢氧化钡溶液 |
以下推理正确的是( )
| A.酸中都含有氢元素,所以含有氢元素的化合物一定是酸 |
| B.碱性溶液能使酚酞试液变红,所以能使酚酞试液变红的溶液一定呈碱性 |
| C.中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 |
| D.碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐 |
产生下列现象,只和空气中的水蒸气有关的是
| A.固体烧碱要密封存放 |
| B.浓硫酸露置于空气中会增重、变稀 |
| C.生石灰暴露在空气中会变质 |
| D.铜制品长期放在空气中会产生“铜锈”[又称“铜绿”,化学式为Cu2(OH)2CO3] |
鉴别下列各组物质,选用的试剂(括号内的物质)正确的是
| A.氢氧化钠溶液和澄清石灰水 (稀盐酸) |
| B.碳酸钠溶液和氯化钠溶液(澄清石灰水) |
| C.氯化钠溶液和稀盐酸 (氢氧化钠溶液) |
| D.稀盐酸和稀硫酸(锌粒) |
除去下列物质中的杂质所选用的试剂及操作方法正确的一组是( )
| |
物质 |
杂质 |
除杂所用试剂和方法 |
| A |
O2 |
HCl气体 |
先通过适量NaOH溶液,再通过浓硫酸 |
| B |
NaOH溶液 |
Ca(OH)2溶液 |
先加入过量Na2CO3的溶液,再过滤 |
| C |
NaCl |
Na2CO3 |
加入澄清的石灰水,过滤 |
| D |
CaO |
CaCO3 |
加入适量的稀盐酸,蒸发 |
某溶液由NaOH、KNO3、HCl、H2SO4和MgCl2中的一种或几种组成。向该溶液中滴加Ba(OH)2 溶液,产生沉淀的质量与加入Ba(OH)2 溶液体积的关系如右图所示。请你从图中获得的信息来分析,该溶液中不可能存在的物质是 ;肯定存在的物质是 。可能存在的是 。
下列除去杂质的方法中,正确的是
| 选项 |
物质(括号内为杂质) |
去除杂质的方法 |
| A |
NaCl溶液(Na2CO3) |
加入过量的CaCl2溶液、过滤 |
| B |
CaO(CaCO3) |
加水、过滤 |
| C |
Fe(Zn) |
加过量FeSO4溶液、过滤 |
| D |
HNO3溶液(H2SO4) |
加适量BaCl2溶液、过滤 |
有一包不纯的固体烧碱,其中可能含有Na2SO4、MgSO4、Ba(OH)2、NaCl中的一种或几种,取少量烧碱样品,按下图所示步进行实验: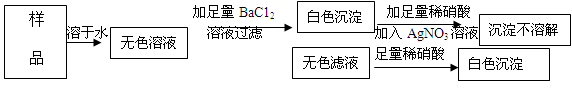
由此可推知该固体烧碱中一定含有 ;一定不含有 。
下列各组物质的溶液,不加任何其他试剂,就能将其一一区别出来的是( )
| A.BaCl2、CuSO4、NaOH、NaCl |
| B.K2SO4、BaCl2、K2CO3、KNO3 |
| C.NaCl、NaOH、H2SO4、Ba(NO3)2 |
| D.NaCl、Na2CO3、Ba(NO3)2、H2SO4 |
下列四组溶液,当后一种溶液加入到一定量的前一种溶液中并稍过量,其溶液导电性与后一种溶液质量的函数关系,符合下图表示的是( )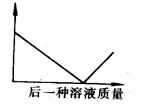
| A.澄清石灰水、碳酸钠溶液 |
| B.稀硫酸、氢氧化钡溶液 |
| C.硝酸银溶液、氯化钠溶液 |
| D.盐酸、氢氧化钠溶液 |
有五瓶失去标签的溶液,它们分别为:①Ba(NO3)2、②NaCl、③NaOH、④Fe2(SO4)3、⑤Na2SO4,如果不用其他试剂(包括试纸),用最简便的方法将它们一一鉴别开来,则鉴别出各物质的先后顺序中,合理的是( )
| A.④③①⑤② | B.④①③⑤② | C.①⑤③④② | D.③④①⑤② |
硝酸钾溶液中混有Mg2+、Ba2+、Ag+三种金属离子,现用KOH、K2CO3、KCl三
种试剂使它们成为沉淀分离出来,要求每次只加一种试剂,滤出一种沉淀,最后达到除去杂质的目的,则所加试剂顺序正确的是( )
| A.KCl、K2CO3、KOH | B.K2CO3、KOH、KCl |
| C.KCl、KOH、K2CO3 | D.KOH、KCl、K2CO3 |
下列图像正确的是( )

| A.向一定量的硝酸钾溶液中不断加水 |
| B.向一定量的稀硫酸中不断加锌粉 |
| C.向一定量的稀盐酸中不断加氢氧化钠溶液 |
| D.向一定量的硫酸和硫酸铜混合溶液中不断加氯化钡溶液 |
水和二氧化碳而变质。某实验小组为确定一瓶久置的碱石灰样品的成分,设计了如图所示实验流程。
请你参与探究过程:
(1)为了使样品充分溶解,操作一还要用到的玻璃仪器是 ;操作二的名称是 。
(2)固体A中一定含有 。
(3)溶液B成分的探究:
【查阅资料】①Ca(OH)2、Na2CO3溶于水无明显的温度变化;
②Na2CO3溶液呈碱性,能使酚酞试液变红;
③CaCl2溶液呈中性。
【猜想】溶液B中的溶质可能为:①NaOH ②Na2CO3
③NaOH和Na2CO3④Ca(OH)2和 (填化学式)。
【设计方案并进行实验】甲、乙同学分别设计如下方案并进行探究:
甲同学:取少量溶液B于试管中,滴加足量的稀盐酸,产生大量气泡,则溶液B中的溶质是Na2CO3。
乙同学:取少量溶液B于试管中,滴加几滴酚酞试液,溶液变成红色,则溶液B中的溶质一定含有NaOH。
【反思与评价】丙同学认真分析上述两位同学的实验,认为他们的结论均有不足之处,并且做出了正确的判断。他认为溶液B中的溶质一定含有Na2CO3,可能含有NaOH。为进一步确认溶液B中是否含NaOH,他做了如下实验。
| 实验步骤 |
实验现象 |
实验结论 |
| ①取少量溶液B于试管中,加入足量CaCl2溶液 ②过滤,在滤液中滴加酚酞试液 |
①有白色沉淀生成 ②溶液由无色变为红色 |
猜想③正确 |
实验步骤①中发生的化学反应方程式是 ,其实验目的是 。
(4)实验过程中,同学们发现向样品中加水时还放出大量的热,综合以上探究,下列对样品成分分析正确的是 (填序号)。
A.一定有NaOH
B.一定有Na2CO3
C.一定有CaO
D.至少有NaOH、CaO中的一种