废旧金属的回收利用不仅可以节约金属资源,而且可以减少对环境的污染。硬铝是铝、铜、硅的合金,是火箭、飞机、轮船等制造业的主要原料。下图是从废铝中回收镁、铝的生产流程(部分生成物省略)

请回答下列问题:
(1)写出 步骤①中的任意一个化学方程式
(2)步骤②中的分离操作为;需用到的玻璃仪器有玻璃棒、烧杯(填仪器名称)
(3)步骤③的化学方程式为:;
(4)步骤④ 的基本反应类型 ;
(5)铝具有很好抗腐蚀性的原因是。
(3分)人类的生活离不开金属材料。
(1)生活中某些食品包装内放一小包铁粉,作用是什么?
(2)某同学在探究铝与稀盐酸的反应时,发现打磨过的铝片反应比未打磨过的铝片反应剧烈,请解释原因可能是什么?
(3)将一定量的锌粉加入到氯化亚铁和氯化铜的混合溶液中,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。请分析滤液中所含溶质情况?
(3分) 向盛有一定质量AgNO3和Cu(NO3)2的混合溶液中的烧杯中逐渐加入Zn粉,并边加边搅拌, 溶液质量与加入Zn的质量关系如图所示。
(1)a点的溶液中含有的金属离子有哪些(写离子符号)?
(2) 写出b~c(不包括b点)段反应的化学方程式。
(3)d点的固体中含有几种物质?
铝土矿的主要成分是氧化铝(所含杂质不参与反应,也难溶于水),工业上用铝土矿制取金属铝的过程如下图所示,请你回答以下问题:
⑴步骤1中发生如下反应:Al2O3+2NaOH===2NaAlO2+X,X的化学式是 。
⑵操作1和操作2中均用到玻璃棒,其作用是 。
⑶步骤2得到的氢氧化铝可以用于治疗胃酸过多,它与胃酸反应的化学方程式是 ,该反应属于 反应(填“化合”、“分解”、“置换”、“复分解”)。
⑷步骤3中发生分解反应,除了生成氧化铝,还有一种常见的氧化物生成。请写出该反应的化学方程式 。
人类的生产、生活离不开金属。
(1)地壳中含量最高的金属元素是 。
(2)用铜制电线主要是利用铜具有良好的延展性和 性。
(3)将生锈的铁片放入足量稀硫酸中,发生置换反应的化学方程式为 。
(4)在硫酸铜和硫酸亚铁的混合溶液中加入一定量的锌粉,充分反应后过滤,向滤渣中滴加稀硫酸,无气泡产生。则滤渣中的金属是 ,滤液中溶质的组成是 (写出所有可能)。
(5)将质量相等的锌粉和铁粉,分别放入两个烧杯中,再分别倒入质量相等、溶质的质
量分数相同的稀盐酸,充分反应,生成氢气的质量(m)随反应时间(t)变化的曲
线如图所示。下列说法正确的是 (填字母序号)。
| A.消耗两种金属的质量相等 |
| B.两烧杯中金属都没有剩余 |
| C.两烧杯中稀盐酸都没有剩余 |
| D.曲线a表示锌和稀盐酸的反应 |
人类的生活和生产都离不开金属材料。
(1)下列物质不属于合金的是 。
| A.青铜 | B.铝 | C.钢 | D.生铁 |
(2)铜可以拉成铜丝,这是利用金属的_________。
(3)焦炭可把铁从赤铁矿石里还原出来,该反应的化学方程式为 。
(4)工业上冶炼金属钛时,其中一步反应的化学方程式为:
TiO2 + 2C + 2Cl2 TiCl4 + 2X,则X的化学式为 。
TiCl4 + 2X,则X的化学式为 。
(5)在ZnCl2和CuCl2的混合溶液中,加入过量的铁粉,充分反应后过滤,所得滤液中含有的溶质是 。
人类的生产和生活都离不开金属
(1)如图所示的金属制品中,利用金属导热性的是 _________ (填字母序号).
(2)铝具有很好的抗腐蚀性能,用电解氧化铝的方法可以制取铝,氧化铝中铝元素和氧元素的质量比为 _________ .
(3)铁是应用最广泛的金属,工业上常以赤铁矿(主要成分Fe2O3)和一氧化碳为原料炼铁,该反应的化学方程式为 _________ .
(4)赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热可得铜,请将反应的化学方程式补充完整:2Cu2O+Cu2S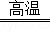 6Cu+ _________ .
6Cu+ _________ .
(5)某实验室废液中含有稀硫酸、硫酸亚铁和硫酸铜,若向其中加入一定量的锌,充分反应后过滤,向滤渣中加入盐酸,有气泡产生.则滤渣中一定含有的物质是 _________ ,滤液中一定含有的物质是 _________ .
用实验验证Zn、Cu、Ag三种金属的活动性顺序,请写出两种可行方案所需的物质。
人类的生活和生产都离不开金属材料
(1)铁生锈的条件是:铁与空气和 直接接触。
(2)根据铁生锈的条件,自行车支架采取的防锈措施是 。
(3)某同学为了验证镁、铁、铜的活动性顺序,他选择了打磨过的铁丝,你认为他还需要选的另外两种溶液是 溶液和 溶液.请根据选定的试剂写出上述实验中发生反应的一个化学方程式 。
生活中处处有化学,日常生活中许多物质都与化学有关.请回答:
(1)从环保角度考虑,化石燃料、氢气、一氧化碳三类燃料中最理想的是.
(2)回收废旧塑料垃圾可减少"白色污染",要解决白色污染问题,还应该从哪些方面入手?(答一点).
(3)金属是一种非常重要的资源,在生产、生活中有着广泛的用途.
①世界上每年钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失.铁在空气中锈蚀,实际上是铁跟等物质相互作用的结果.试举一种能减缓钢铁锈蚀的方法;工人师傅在焊接钢铁制品时,通常先用稀盐酸清洗制品,原因是(用化学方程式表示).
②小明同学欲验证X,Y,Z三种金属的活动性,根据实验得出如下结论:
A.X和稀硫酸不反应
B.
C.
这三种金属的活动性强弱顺序是.
向
粉与过量稀
反应后的溶液中滴加
溶液,溶液由浅绿色变为黄色,无气泡产生;继续滴加
溶液,有气泡出现;反应后滴加
溶液有白色沉淀.
(1)溶液由浅绿色变为黄色的化学反应方程式:.
(2)产生气泡的化学反应方程式:.
如图所示,取三根粗细、长度均相同的光亮细铁丝,将其中两根分别盘成螺旋状,在每根铁丝一端绑上粗铜丝,另一端系一火柴,点燃火柴,待快燃尽时,分别插入充满氧气的集气瓶中(预先放入一些水).观察到:I、II中铁丝都剧烈燃烧,且II中铁丝燃烧比I中的更剧烈;III中铁丝没有燃烧.

(1)为什么III中铁丝不能燃烧?
(2)分析II中铁丝燃烧比I中的更剧烈的原因.
化学实验是学习化学的重要方法.请完成下列金属性质的实验.
(1)实验一:比较铁、铜的金属活动性强弱.请你设计实验完成下表内容.
| 实验步骤 |
实验现象 |
结 论 |
| 金属活动性: |
(2)实验二:镁、锌、铁三种金属与酸的反应.
[实验]取一定量的镁、锌、铁三种金属分别加入到溶质质量分数相同的稀硫酸中,充分反应,观察现象.
[结论]活泼金属能与酸反应.
[分析]①三个反应的共同特点是,写出其中一个反应的化学方程式.
②若完全反应后,三个反应生成氢气的质量相等,原因是.
结合下列有关铁的实验,回答有关问题:
(1)铁丝在氧气中燃烧的实验:
点燃系在螺旋状细铁丝底端的火柴,待火柴将要燃尽时,插入盛有氧气的集气瓶中,观察现象.这根火柴的作用是;为了防止集气瓶底炸裂,应采取的方法是.
(2)如图是探究铁钉锈蚀条件的实验:
①A中植物油的作用是;
②一段时间后,B中铁钉没有锈蚀,而C中铁钉锈蚀,通过B、C对比说明铁钉锈蚀的条件之一是.

某化学小组用一定量
和
的混合溶液进行了下图实验,已知溶液甲呈蓝色。

(1)向固体乙上滴加盐酸时(填"有"或"没有")气泡产生。
(2)溶液甲中一定含有哪些溶质?(写化学式)
(3)请写出该实验过程中所发生反应的化学方程式。