广东省广州市海珠区中考一模化学试卷
下列变化中没有新物质生成的是
| A.用稀硫酸除铁锈 | B.氧化钙用作干燥剂的过程 |
| C.由乙烯聚合成聚乙烯 | D.干冰升华 |
下列叙述中,正确的是
| A.原子中一定含有质子、中子、电子三种粒子 |
| B.“花香四溢”的现象说明分子之间有一定的间隔 |
| C.氯化钠是由钠原子和氯原子构成的 |
| D.蔗糖溶液里有不同种分子,属于混合物 |
下列说法中,正确的是
| A.镁带在空气中不能燃烧 |
| B.在氧化钙中加入适量的水,会放出热量 |
| C.木炭燃烧后生成黑色固体 |
| D.电解水时,负极产生的气体是氧气 |
下列说法中,不正确的是
| A.碘是人体必需的微量元素 |
| B.燃烧法不能区别羊毛和腈纶 |
| C.米和面中含有的糖类物质主要是淀粉 |
| D.棉花和涤纶,前者是天然纤维,后者是合成纤维 |
与元素化学性质关系最密切的是
| A.原子的最外层电子数 | B.原子的核外电子数 |
| C.元素的核电荷数 | D.元素的相对原子质量 |
乙醇(C2H5OH)常用作酒精灯、内燃机等的燃料。下列关于乙醇的说法错误的是
| A.属于有机物 |
| B.1个分子由2个碳原子、6个氢原子和1个氧原子构成 |
| C.所含碳元素的质量分数为52.2% |
| D.23g乙醇中碳元素的质量是6g |
下列反应属于复分解反应的是
| A.锌片投入稀硫酸中 | B.一氧化碳与氧化铜在加热条件下反应 |
| C.纯碱与盐酸 | D.在过氧化氢溶液中加入二氧化锰 |
下列关于碳和碳的氧化物的说法中,正确的是
| A.CO和CO2都可以用碳与氧气反应得到 |
| B.CO和CO2都是无色、无味的有毒气体 |
| C.用石蕊溶液不能区分CO和CO2 |
| D.C与CO2反应要放出热量 |
下列有关溶液的说法中,正确的是
| A.乳化能增强乳浊液的不稳定性 |
| B.在其它条件不变时,氮气的溶解度随压强的升高而减小 |
| C.均一、稳定的液体都是溶液 |
| D.同一种物质在不同溶剂中的溶解性不同 |
下图是某粒子的结构示意图,下列叙述正确的是
| A.该粒子第一电子层有8个电子 |
| B.该粒子是阴离子 |
| C.该元素属稀有气体元素 |
| D.该粒子的核电荷数是18 |
下列关于化肥、农药的说法中,正确的是
| A.尿素[CO(NH2)2]是一种常用的复合肥料 |
| B.为增强肥效,应将硫酸铵与熟石灰混合施用 |
| C.农药施用后,会通过农作物、农产品等发生转移 |
| D.通过闻气味的方法,不能将氯化铵和碳酸氢铵区别开来 |
向15mLpH为5的溶液中加入等体积的下列试剂,混合液的pH肯定增大的是
| A.氢氧化钠溶液 | B.稀盐酸 |
| C.稀硫酸 | D.pH为5的溶液 |
有X、Y、Z三种金属,只有Z在自然界中主要以单质形式存在,如果把Y加入X的硝酸盐溶液中,Y表面有X析出,则这三种金属的活动性由强到弱的顺序为
| A.Y>Z>X | B.Y>X>Z | C.X>Y>Z | D.Z>Y>X |
下列实验能观察到明显现象变化的是
| A.硝酸银溶液滴入氯化钠溶液中 |
| B.稀盐酸滴入硫酸钠溶液中 |
| C.氢氧化钠溶液滴入氯化钡溶液中 |
| D.硫酸钠溶液滴入碳酸钡中 |
推理是化学学习中常用的思维方法。下列推理正确的是
| A.燃烧需要同时满足三个条件,所以灭火时也要同时控制这三个条件 |
| B.H2O和H2O2的组成元素相同,所以它们的化学性质相同 |
| C.中和反应生成盐和水,生成盐和水的反应一定是中和反应 |
| D.蜡烛燃烧生成CO2和H2O,所以蜡烛组成里一定含有C元素和H元素 |
下列实验方案或操作中,正确的是
| A.用燃烧的木条即可把N2、O2和CO2区别开来 |
| B.按溶解、过滤、洗涤、蒸发结晶的操作顺序,可分离氯化钾和二氧化锰的混合物 |
| C.测定某溶液pH的操作是:将pH试纸直接插入待测液中,再取出与标准比色卡对照 |
| D.在稀盐酸与氢氧化钠反应后的溶液中滴加酚酞溶液不变色,可断定两者恰好完全反应 |
(3分)化学与生产、生活密切相关。请用下列物质的序号填空。
①甲醛;②天然气;③大理石;④木炭;⑤氯化钠。
(1)属于化石燃料的是__________。
(2)其水溶液可用于浸泡动物标本的是 。
(3)可用来制取氢氧化钠、氯气等的是 。
(4分) 用化学用语表示。
(1)3个硫原子 ;氧化钠 ;氯酸钾 。
(2)碳酸钙、碳酸钠均能与稀盐酸反应生成CO2,是因为碳酸钙、碳酸钠中均含有 (写
离子符号)。
分析以下化学反应的微观示意图,并回答问题: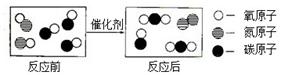
(1) 表示A物质的分子,则A物质的化学式为 。
表示A物质的分子,则A物质的化学式为 。
(2) 表示B物质的分子,B物质中碳、氧元素的质量比是 。
表示B物质的分子,B物质中碳、氧元素的质量比是 。
(3)该反应前后涉及到的化合物共有 种。
(4)参加反应的两种物质的分子个数比是 。
人类的生活和生产都离不开金属材料。
(1)下列物质不属于合金的是 。
| A.青铜 | B.铝 | C.钢 | D.生铁 |
(2)铜可以拉成铜丝,这是利用金属的_________。
(3)焦炭可把铁从赤铁矿石里还原出来,该反应的化学方程式为 。
(4)工业上冶炼金属钛时,其中一步反应的化学方程式为:
TiO2 + 2C + 2Cl2 TiCl4 + 2X,则X的化学式为 。
TiCl4 + 2X,则X的化学式为 。
(5)在ZnCl2和CuCl2的混合溶液中,加入过量的铁粉,充分反应后过滤,所得滤液中含有的溶质是 。
氢氧化钴[Co(OH)2] 可作涂料和清漆的干燥剂,其制备方法是:把金属钴与稀盐酸反应制得氯化钴(CoCl2),再将氯化钴溶液与氢氧化钠溶液反应制得氢氧化钴。
查阅资料:氯化钴溶液是粉红色,氢氧化钴是难溶于水的粉红色固体。请回答:
(1)金属钴与稀盐酸反应的化学方程式为 。
(2)氯化钴溶液与氢氧化钠溶液反应的现象是 ,化学方程式为 。
(3)下列说法正确的是 。
A.钴的金属活动性比铜的强
B.氢氧化钴可以干燥氯化氢气体
C.氯化钴溶液也能和石灰水反应
甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
(1)t1℃时,甲物质的溶解度 (填“大于”、“小于”或“等于”)乙物质的溶解度。
(2)t1℃时,100g水中最多能溶解丙物质 g。
(3)t2℃时,把等质量的甲、乙两物质的饱和溶液降温到t1℃,析出晶体较多的是 。
(4)t2℃时,向盛有100g水的烧杯中加入60g甲物质,充分溶解后,所得溶液溶质的质量分数是 (计算结果精确到0.1%)。
某校化学兴趣小组的同学探究如何利用水垢制取氯化钙。水垢的主要成分是CaCO3和Mg(OH)2,由水垢制取氯化钙的流程如下: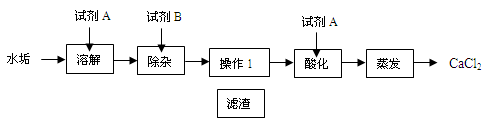
请回答:
(1)“试剂A”是一种酸,其化学式为 。
(2)“试剂B”是氢氧化钙,加入其除去的主要杂质离子是 ,所发生反应的化学方程式为 ;“试剂B”不能选用氢氧化钠,理由是 。
(3)“酸化”的主要目的是 。
(4)“操作1”中,需要用到的玻璃仪器除烧杯、玻璃棒外,还有 。
A、B、C、D、E、F都是初中化学中常见的化合物,其中B是酸,C、E是盐,而且C可用作钾肥,F是蓝色。它们相互在溶液中可发生如下反应:
2A + B ="=" C + 2D ② 2A + E ="=" F↓ + C ③ B + F ="=" E + 2D
根据上述信息回答问题:
(1)写出有关物质的化学式:C ;F 。
(2)写出下列反应的化学方程式:
反应① ;
反应② 。
请根据下列装置回答问题: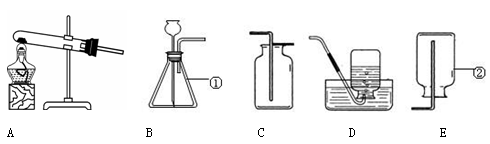
(1)写出①、②的仪器名称:① ;② 。
(2)实验室用高锰酸钾制取氧气的化学方程式为 ,用D装置收集O2的操作中,导管口开始有气泡放出时,不宜立即收集,原因是 。
(3)实验室可用碳酸氢钠固体加热分解(产物为碳酸钠、二氧化碳和水)来制取CO2,反应的化学方程式为 ,用此法来制取CO2,应选用的气体发生装置是 (填字母)。
(4)用E装置可以收集O2、Cl2、CH4、NH3等气体中的 。
铜器在潮湿的空气中容易生锈。铜锈(俗称铜绿)的主要成分是Cu2(OH)2CO3,那么,铜在什么条件下容易生锈呢?为此,小明同学设计了以下实验,请你参与探究。
【提出假设】铜生锈是铜与氧气、 和 共同作用的结果。
【设计方案】为验证假设,小明同学设计了以下实验方案: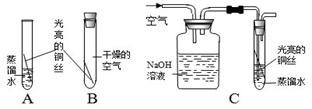
(1)B的实验目的是 。
(2)装置C中有一处明显错误,用文字叙述加以改正 ;NaOH溶液的作用是(用化学方程式表示) 。
(3)小明同学的这个实验方案不完整,还需要再补充一个实验。请在下图框中绘出该实验的装置图。
【结论】经过探究,得知了铜生锈的条件。
为探究酸碱盐之间的反应,小红同学做了以下实验:在稀硫酸中加入了一定量的硝酸钡溶液。请回答:
(1)观察到的实验现象是 ,反应的化学方程式为 ,分析实验现象,溶液中减少的离子是 (写离子符号)。
(2)小红同学在稀硫酸中加入硝酸钡溶液时,硝酸钡溶液可能过量,检验溶液中含有少量
硝酸钡的方法是 。
(3)在98g质量分数为10%的稀硫酸中加入100g硝酸钡溶液,恰好完全反应,所加硝酸钡溶液中溶质的质量分数是 (计算结果精确到0.1%)。
(4)若要配制98g质量分数为10%的稀硫酸,需要质量分数为98%的浓硫酸(密度为
1.84g/cm3) mL(计算结果精确到0.1)。在实验室用浓硫酸配制稀硫酸的主要步骤有:计算、 、混匀、冷却至室温装瓶,并贴上标签。

 粤公网安备 44130202000953号
粤公网安备 44130202000953号