冬季冰雪覆盖路面,会给交通带来很多不便。
(1)为了疏通道路常使用铲雪车铲雪,铲雪车的铲斗是用锰钢制造的。
①锰钢的主要成分是Mn、C和____。
②锰钢属于 。
| A.合成材料 | B.合金 | C.金属材料 | D.化合物 |
(2)有一类融雪剂是以醋酸钾(CH3COOK)为主要成分的有机融雪剂。醋酸钾中钾元素的质量分数是 (最后结果保留一位小数)。
(3)还有一类融雪剂是以“氯盐”为主要成分的无机融雪剂,统称作“化冰盐”。常用工业碳酸钙(含有少量NaCl、FeCl3等杂质)为原料生产该融雪剂。主要生产流程如下图所示。已知:Fe(OH)3为难溶的碱。
①“操作1”的名称是 ;溶液A中加入过量熟石灰,发生反应的化学方程式是 。
②第二次加入盐酸的主要目的是 。
③固体乙的成分是 。
铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关。
(1) 在空气中铝制品更耐腐蚀,原因是 。(写出化学方程式)
(2) 人们大量使用的是合金而不是纯金属,这是因为合金具有更多优良性能,例如钢比纯铁硬度 (填“大”或“小”)。
(3)用下列试剂验证这三种金属的活动性顺序,能达到目的的是 (填序号)。
A.硫酸铝溶液 B.硫酸亚铁溶液 C.硫酸铜溶液
金属在生产生活中起着重要的作用。
(1)铜可以做电线,利用了金属铜的延展性和 性。
(2)铝在空气中表现出良好的抗腐蚀性能,用化学方程式表示其原因 。
(3)工业常用赤铁矿(主要成分是氧化铁)和一氧化碳冶炼铁,该反应的化学方程式是 。
(4)向一定量的氧化铜中加入稀硫酸使其完全溶解,得到一种蓝色溶液。再加入铁粉充分反应,过滤,得到滤渣和滤液。向滤渣中加入足量稀硫酸,有气泡冒出,充分反应后,剩余固体的质量为12.8 g。
①氧化铜与稀硫酸反应的化学方程式是 。
②滤渣的成分是 。
③氧化铜的质量为 g。
应用所学知识,回答下列有关金属的问题:
(1)将锌、铜、铁三种金属分别投入到足量的稀硫酸中,反应最快的是 ,不能反应的是 ,三种金属由强到弱的顺序是 。
(2)将一根生锈的铁钉投入到足量的稀盐酸中,观察到铁锈逐渐溶解,溶液由无色变为黄色,其原因是 (用化学方程式回答),一段时间后有无色气体产生,其原因是 (用化学方程式回答)。
(3)镁条在空气中燃烧,不足以证明镁能够和氧气反应,其理由及需补充一个实验来证明镁能够和氧气反应是 。
生产、生活中广泛使用着金属及金属材料。
(1)金属钛(Ti)及钛的合金被认为是21世纪重要的金属材料。地壳中的钛主要以氧化物的形式存在,其中钛元素的化合价是+4价,该氧化物的化学式为 。
(2)防止铁制品锈蚀需要了解铁锈蚀的条件。铁锈蚀的条件是 。
(3)实验室废液中含有硝酸银、硝酸铜,实验小组利用稀硫酸和铁粉分别回收银和铜,设计如下方案。
先在废液中加入过量的铁粉,充分反应后过滤得到滤渣A,其成分为____。再对滤渣A按如下流程图处理:
①先再废液中加入过量的铁粉,过量的目的是 。
②含有硫酸亚铁的滤液有 (填框图中字母)。
③如果在过滤操作中发现滤液浑浊,在仪器洁净、滤纸未破损的前提下,你认为滤液的浑浊的原因可能是 。
回答以下问题:
⑴应用金属活动性顺序能帮助我们进一步学习金属性质。已知下列各组物质间均能发生置换反应。
A.Fe 和CuSO4溶液 B.Mg和MnSO4溶液 C.Mn和FeSO4溶液
①写出Fe 和CuSO4溶液反应的化学方程式 。
②在相同条件下,四种金属中能与盐酸反应且最剧烈的是 。
⑵氯化铁能腐蚀铜,工业上常用此原理生产印刷线路板。印刷线路板的生产及废液的处理过程如下:
①步骤Ⅱ中发生了两个反应:Fe + 2FeCl3 = 3FeCl2和Fe + CuCl2 = FeCl2 + Cu。滤渣的成分是 ,滤液中的溶质是 。
②步骤Ⅲ中发生反应的化学方程式为 。
③氯化铁能腐蚀铜的原因是(用化学方程式表示) 。
人类的生产生活离不开金属。
(1)铁生锈的条件是铁与 直接接触。
(2)铜制品如果长期暴露在空气中也会生锈,已知铜锈化学式为Cu2(OH)2CO3。试判断铜生锈除满足铁生锈的上述条件外,还需要空气中的__________。
(3)在生活中经常用一些铝制品代替铁,铝耐腐蚀的原因是___________。[填序号]
A. 铁比铝活动性弱
B. 铝与氧气反应在其表面生成致密的氧化物保护膜
C. 常温下,铝不与稀盐酸、稀硫酸等稀酸溶液反应
(4)如右图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是 。[填序号]
A.向左偏 B.向右偏
C.先向左偏后向右偏 D.先向右偏后向左
(5)向一定量的铁粉中逐滴加入稀硫酸至过量,右图是反应过程中某种物质的质量Y随加入稀硫酸的质量变化的关系,则Y可能表示 。[填序号]
A.消耗铁粉的质量 B.生成硫酸亚铁的质量
C.溶液的总质量 D.生成氢气的质量
我国劳动人民早在春秋战国时期就已经懂得钢铁冶炼,铁也是生活中使用最为广泛的金属,目前我国钢铁产量已经位居世界第一。下面是一组有关铁的问题,请你用所学化学知识加以回答:
(1)用赤铁矿(Fe2O3)炼铁的化学反应方程式是 。成语“千锤百炼”就源于生铁炼钢的过程,该过程中发生化学反应的化学方程式是 。
(2)铁可以拉成铁丝,压成铁片,这是利用了铁的 性;在公路上行驶的油罐车尾部经常有一条铁链拖在地面上,这是利用了铁的 性;家里铁制炊具要有木柄或塑料柄,这是因为铁有很好的 性;
(3)焊接钢管时,经常用硫酸铜溶液在钢管表面画交叉线,然后根据出现的红线对准焊接,用化学方程式表示反应原理 。
(4)经研究发现,长期使用我国发明的铁锅炒菜做饭,可有效地减少缺铁性贫血的发生,如果在炒菜时经常加入适量的食用醋,效果会更好,理由是_________________ 。
(5)某同学在做盐酸和锈铁钉反应实验时,发现含锈的铁钉表面出现了气泡,你觉得原因是 。
Fe、Cu、Mg、Zn是几种金属活动性不同的金属,将它们同时放入稀盐酸中,出现了下图表示的情景。请分析它们的表白后填写下列空白。
(1)大喊“我快要完蛋了”的金属是 ;说“我一点不在乎”的金属是 。
(2)有一种金属坚持不住了,用化学方程式表示其原因:
(3)取出勉强能行的金属放在氧气中燃烧的化学方程式为
(4)用熟石灰中和该实验后的酸性废液,其化学反应方程式为:
) 钢铁是使用最多的金属材料。
⑴早在春秋战国时期,我国就开始生产和使用铁器。写出以赤铁矿(主要成分Fe2O3)为原料炼铁的化学方程式 。
⑵利用新技术能将不锈钢加工成柔软的金属丝,用它和棉纤维一起编织成性能优良的劳保防护服,这是利用了不锈钢的 (填序号)。
A.耐腐蚀性 B.延展性 C.导热性 D.导电性
⑶市场上有一种含铁粉的麦片,食用后在胃酸作用下将铁粉转化为人体可吸收的铁元素,反应的化学方程式为 。这种麦片必须真空保存,原因是 。
(4)为探究铁和锌两种金属与酸反应的状况,将等质量的两种金属分别与等质量的溶质质量分数相同的稀硫酸反应,产生氢气的质量与反应时间的函数关系如图所示。下列相关判断中,正确的是 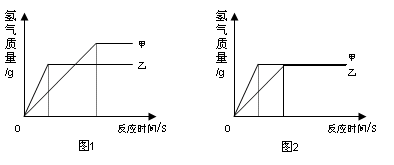
A.甲是铁,乙是锌
B.甲是锌,乙是铁
C.图1表示稀硫酸足量,图2表示稀硫酸不足量
D.图1表示金属一定有剩余,图2表示金属一定没有剩余
汽车是现代生活中不可缺少的代步工具。请回答下列问题:
(1)汽车电路中的导线大都是铜制的,这是利用了金属铜的延展性和____________性。
(2)下列汽车配件及用品中,属于有机合成材料的是(填序号,下同)__________。
a.钢铁外壳 b.玻璃车窗 c.橡胶轮胎 d.羊毛座垫
(3)铁在潮湿的空气中容易锈蚀。
①汽车表面喷漆,可以延缓汽车的锈蚀,其防锈原理是隔绝____________和水。
②喷漆前需将铁制品放入稀盐酸中除锈(铁锈主要成分是Fe2O3),观察到溶液变黄,有无色气泡逸出,反应的化学方程式是___________;___________。
(4)回收再利用生锈的铁制品是保护金属资源的一种有效途径。右图所示的废铁粉中Fe2O3含量大约在80%(其余20%为铁)左右,回收后在工业上常用一氧化碳将其还原,反应的化学方程式是_______________,若回收100 t这样的废铁粉可以得到__________t铁。
(6分)金属材料在生活、生产中应用十分广泛。
(1)右图A是金属的一个应用实例,其利用金属的主要性质是____;右图B是两块金属片相互刻划后,在纯铜片上有明显的划痕。由此可得到的结论是____。
(2)写出工业上用一氧化碳与赤铁矿冶炼生铁的化学方程式_________________________。
(3)某兴趣小组同学欲从含有硫酸、硫酸亚铁、硫酸铜的废液中回收全部的铜,并得到副产品硫酸亚铁,设计流程如图所示。
加入的 是____;写出上述有关反应的化学方程式______________。
是____;写出上述有关反应的化学方程式______________。
钢铁是使用最多的金属材料。
(1)下图为实验室炼铁的装置图,A中反应的化学方程式是 ;将反应后的气体通过装置B和C,收集较纯净的CO并循环使用,B中应盛放的试剂是 浓溶液。
(2)工业上可用酸清洗锈蚀的金属。将生锈的铁片和生锈的铜片[铜锈的成分Cu2(OH)2CO3]同时放入一定量盐酸中,可能发生的化学反应有:
①铜锈溶解:Cu2(OH)2CO3+ 4HCl= 2CuCl2 + 3X + CO2↑,则X的化学式为 ;
②铁锈溶解:化学方程式为 ;
③有金属单质生成:化学方程式为 。
(3)某化学小组欲测定一种钢样品中铁的含量,实验操作如图所示,实验结果记录如下表:
| 反应时间 |
t0 |
t1 |
t2 |
t3 |
| 烧杯和药品质量/g |
55.7 |
55.6 |
55.5 |
55.5 |
①经计算,这种钢样品中铁的含量是 % (精确到0.1%)。
②有同学提出,灼烧可使钢中的碳转化为二氧化碳,钢样品质量会减轻。但是他们将一定量的钢样品灼烧后,发现质量反而增加了,其原因是 。
人类的生产生活离不开金属。
(1)金属铁、铝常用来制作炊具,主要是利用其 。
(2)人类每年从自然界提取大量的金属,其中提取量最大的是铁。用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为 。
(3)我国钢铁年产量很高,但因锈蚀造成的损失也很惊人。右图是探究铁生锈条件的装置,据图回答问题:
一段时间后可观察到的现象是 ,由此说明铁生锈的条件是 。
(4)从含有CuSO4、ZnSO4、FeSO4的废水中回收重要原料硫酸锌和有关金属,实验过程如下:
请回答:
固体丙的化学式为 ;写出步骤①中反应的化学方程式 。
铁、铜等金属在我们的生活和工业生产中应用很广。
(1)制造汽车所用的钢材是 (填“铁”或“铜”)的合金,这种金属在活动性顺序中排在(H)的 面;为保护汽车的金属外壳,表面通常喷一层油漆,其主要作用是隔 绝 ,防止金属锈蚀。
(2)某工厂利用废铁丝、硫酸铜废液(含硫酸亚铁)和废铜粉制备硫酸铜晶体。具体过程如下: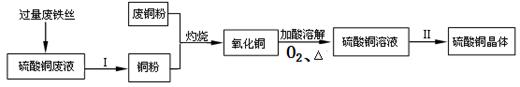
①废铁丝投入到硫酸铜废液里发生反应的化学方程式为 ,废铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,其目的是 。
②过量废铁丝与硫酸铜废液充分反应后,为了得到纯净的铜粉,Ⅰ的主要步骤是 。
③在“氧化铜”(含少量铜)转化为硫酸铜溶液的过程中,以下化学反应方程式与该过程有关的是 。
A.2Cu+ O2 2CuO 2CuO |
B.2Cu+O2+2H2SO4 2CuSO4+2H2O 2CuSO4+2H2O |
C.Cu + H2SO4  CuSO4 + H2 ↑ CuSO4 + H2 ↑ |
D.CuO + H2SO4  CuSO4 + H2O CuSO4 + H2O |