如图所示,两只U型管中分别加入纯净、等质量的铝粉和铁粉,同时将两端注射器内的液体(等质量、浓度为20%的稀硫酸)快速注入U型管中。
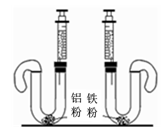
(1)写出铁粉与稀硫酸发生反应的化学方程式 。
(2)反应结束并冷却至室温,发现左端气球膨胀程度明显大于右端,若仅有一只U型管内的硫酸有剩余,则是 (填“左”或“右”)端的U型管。
(3)若将铝粉和稀硫酸换成其他两种化合物(或其溶液),也能观察到气球明显膨胀,这两种物质可能是(写化学式) 。
铁是应用最广泛的金属.新型材料纳米级Fe粉能用作高效催化剂.实验室采用还原法制备纳米级Fe粉,其流程如图所示:
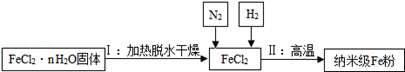
(1)纳米级Fe粉在空气中易自燃.实验中通入N2的目的是 。
(2)写出Ⅱ中H2还原FeCl2得到铁的化学方程式 ,该反应属于基本反应类型中的 反应。
某校化学实验室废液桶中收集了溶解大量FeSO4、CuSO4的废水,若直接排放到下水道不仅造成重金属污染而且造成浪费。初三(2)班的同学,准备运用刚学到的“常见金属活动性顺序表”结合其他有关化学知识对废水进行处理。
(1)设计除去铜离子,回收硫酸亚铁晶体和铜的实验方案,讨论有关问题:

①废水在加入金属X前需进行过滤,目的是将其中__________性杂质除去。进行过滤的操作所需的仪器有:________、________、________、________(请从下图中选择合适仪器,并用仪器名称填写)。

②金属X是_____________,其加入废水后发生反应的化学方程式为___ ____溶液Y是________利用其除去铜中杂质,有关反应的化学方程式为______________
氯化铁溶液能与铜反应生成可溶性的氯化铜和氯化亚铁,工业上常用此原理生产印刷线路板。以下是印刷线路板的生产及废液的处理过程:
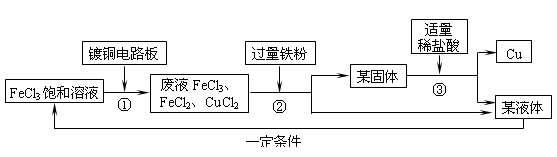
请回答下列问题:
(1)步骤②③中实验操作的名称是 。
步骤②实验操作前发生了两个反应:2FeCl3+Fe = 3FeCl2和 ,
(2)步骤③中适量稀盐酸的标志是 ;
发生反应的化学方程式是 。
(3)该流程中可以循环、回收利用的物质是 。
若将一定量的铁粉投入到入一定量只含有Cu(NO3)2、AgNO3的工业废水中,充分反应后过滤,向所得滤渣中滴加稀盐酸,没有气泡产生,则滤渣中一定含有的金属是 ;一定不含有的金属是 。
根据下列图示的探究过程,回答下列问题:

(1)操作①的名称.
(2)图中固体中含有的物质(化学式).
(3)写出步骤②发生反应的化学方程式.
请按要求完成下列金属性质的实验:
研究一:金属与酸反应过程中的能量变化.
(1)打磨后的镁条与稀盐酸反应,试管外壁发烫,说明该反应(填"吸热"或"放热"),反应的化学方程式为.
(2)实验测得反应中产生的气体的速率(
)与时间(
)的关系如图,请根据时间
段反应速率变化,说明化学反应速率受等因素影响.

研究二:金属与盐溶液反应过程中的相关变化.
(1)某同学用硫酸铜溶液把"铁勺"变"铜勺",其反应的化学方程式为.
(2)在一定量
和
的混合溶液中加入铁粉,充分反应后,下图描述相关变化曲线,一定不正确的是.

根据下面部分金属的活动性顺序回答:

(1)上述金属中活动性最强的是;
(2)按年代最早被广泛使用的金属是;
(3)已知:①
②
③
与稀硫酸不反应。则符合要求的
、
、
分别是(填字母序号)。
| A. |
、 、 |
B. |
、 、 |
C. |
、 、 |
金属材料在生产、生活与科学研究中应用广泛。
(1)钢铁是使用最多的金属材料,钢的硬度比纯铁的硬度(填"大"或"小")。
(2)自行车构件中的支架是铁制品,为防止它锈蚀,在其表面刷漆,其防锈原理是。
(3)某废旧站回收的混合金属中含有铜、金和少量的镍,经过初步处理成粉末后,随意将三种金属编号成X、Y、Z,进行如下回收流程:

①操作a的名称是。
②铜、金、镍三种金属的活动性由强到弱的顺序是。
③写出步骤IV反应的化学方程式。
在各种金属材料中铜是人类应用比较广泛的金属之一,某学习小组欲测定铜的相对原子质量,设计如下实验方案:
实验步骤:①连接好装置,②-----③装入药品 ④打开分液漏斗活塞向锥形瓶中滴加入稀盐酸 ⑤一段时间后点燃酒精灯⑥D中黑色固体完全变成红色,停止加热,待D中玻璃管冷却至室温,关闭分液漏斗活塞 ⑦数据处理

请回答下列问题:
(1)补全实验步骤②。
(2)若使制取氢气是装置随开随用,随关随停,下列装置可选用的是。

(3)B装置中水的作用,长玻璃管的作用,C装置的作用.
(4)已知: 样品质量为m1克,E中增重为m2克,D中反应后固体质量为m3克,实际参加反应氢气的质量为m4克,试用m1,m2列出铜的相对原子质量的表达式。若无F装置,则对测定结果的影响(填"偏大"、"偏小"、"无影响"),以下数据还能测定铜的相对原子质量的是。
| A. | m 2 m 3 | B. | m 3 m 4 | C. | m 1 m 4 | D. | m 2 m 4 |
(5)请你评价实验有什么不妥之处,并说明原因。
为了测定某含杂质7%的黄铜样品中铜的质量分数(杂质中不含铜、锌元素,杂质不溶于水,不与其它物质反应,受热也不分解),某化学小组进行了如下实验:

(1)配制上述质量分数为14.6%的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是;
(2)发生反应的化学方程式为;
(3)根据已知条件列出求解100g该黄铜样品中锌的质量(x)的比例式为;
(4)该黄铜样品中铜的质量分数是;
(5)向过滤后所得滤液中加入87.4g水,则最终所得溶液中溶质的质量分数是;
(6)欲将黄铜样品中的铜转化为铜盐,可将过滤后所得的不溶性物质洗涤、烘干,然后在空气中加热,充分反应,则可得到含杂质的氧化铜的质量是,再经过某些反应及操作就得到了所需铜盐。
某金属冶炼厂的工业废渣中含有泥沙和某些单质,其中单质含有铜、锌和少部分硫。现欲回收铜和锌,并对硫进行处理,主要流程如下图所示:

(1)在废气
中,一定含有的有害气体是(填化学式)。操作①的操作名称是。
(2)溶液
中含有的溶质是(填化学式)。
(3)写出加入
后发生的化学方程式(写出其中之一即可)。
金属材料与人类的生产和生活密切相关。请回答:
(1)下列用品中,主要利用金属导电性的是(填字母)
A.铂金饰品 B.铁锅 C.铝导线
(2)为了验证铝、铜、银三种金属的活动性顺序,设计了下列四种方案,其中可行的是(填 序号)
①将铝、银分别浸入到硫酸铜溶液中
②将银分别浸入到硫酸铝、硫酸铜溶液中
③将铜、银分别浸入到硫酸铝溶液中
④将铜分别浸入到硫酸铝、硝酸银溶液中
(3)在氯化铜和氯化亚铁的混合溶液中加入一定质量的镁粉,充分反应后过滤,得到滤渣和滤液。
①滤液中一定含有的溶质是(填化学式);
②向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是(填化学式)。
(4)某钢铁厂每天需消耗4900t含
76%的赤铁矿石,该厂理论上可日产含
98%的生铁的质量是t。
用废弃的金属镁、铁、铜制取重要化工原料MgSO4的实验过程如下:
请回答:
(1)操作①中被磁铁吸引的金属A是 ;金属B是 。
(2)操作a的名称是 ;在蒸发过程中需要使用玻璃棒,其作用是 。
(3)写出步骤②所涉及的化学反应方程式: ;
(4)实验步骤②中除了加入稀硫酸外,还可选用下列试剂 (填序号)。
a.硫酸铜溶液 b.氯化钠溶液 c.硝酸银溶液
金属及金属材料在生产、生活中应用广泛。
(1)铁及其合金常用作于铁锅等炊具,主要利用了铁具有优良的 。
(2)铝在空气中容易形成一层致密的氧化膜,从而保护铝不会进一步被氧化。请用化学方程式表示该氧化膜的形成过程 。
(3)铁在潮湿的空气中会生锈。铜在潮湿的空气中也会生锈,生成铜绿(一种不溶于水的绿色粉末,化学式是Cu 2 (OH)2CO3)。推测铜生锈的反应中反应物除了有铜和氧气外,还有______________。根据铜绿的组成推测它与稀硫酸反应的现象 。
(4)若只用一种试剂就可以比较铁、铜、镁的三种金属的活动性,可选用下列试剂中的 。
| A.FeSO4溶液 | B.NaOH溶液 | C.稀硫酸 | D.Na2SO4溶液 |
(5)将铁粉放入含有Mg(NO3)2、Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,向滤渣中滴加稀盐酸,有气泡产生,则滤液中存在的溶质是 。