欲测定Cu-Zn合金及Cu-Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器。
(1)你认为能测出铜的质量分数的是 合金;
(2)取该合金的粉末26g加入该硫酸充分反应,所加稀硫酸与生成气体的质量关系如图所示,则

①生成气体的质量为 g.
②请计算:该合金中铜的质量分数;合金与酸恰好完全反应时所得溶液的溶质质量分数。
(写出计算过程)
将黄铜(铜锌合金)粉末20g与足量稀硫酸反应,得到0.2g氢气。
(1)计算这种合金中铜的质量分数。
(2)将黄铜片和纯铜片互相刻画,纯铜片上留有刻痕,说明。
一瓶未贴标签的粉末状常见金属
。为了测定
的相对原子质量,准确称取一定量金属粉末,在坩埚内加强热使其完全氧化,冷却后再称重。重复实验,获得如表数据。请回答:
| 实验次数 |
金属质量(
) |
金属氧化物质量(
) |
| l |
45.0 |
84.9 |
| 2 |
45.0 |
85.1 |
| 3 |
45.0 |
85.O |
| 平均值 |
45.0 |
(1)表格中
。
(2)该金属氧化物中,
元素和氧元素的质量比为。
(3)已知
的化合价为+3价,则
的相对原予质量为。
某化学兴趣小组利用课余时间在实验室进行如下两个探究实验:
【探究一】利用废水回收铜,制备硫酸亚铁晶体。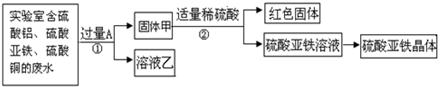
(1)红色固体是 (填化学式);溶液乙中溶质是 。
| A.硫酸铝 | B.硫酸亚铁 | C.硫酸铝和硫酸亚铁 | D.硫酸铜和硫酸铝 |
(2)写出步骤①的化学方程式: ;
【探究二】某硫酸亚铁晶体(FeSO4·xH2O)热分解研究并对x的测定
该兴趣小组同学称取ag硫酸亚铁晶体样品,先通干燥的氮气,然后按下图装置高温加热,使其完全分解,对所得产物进行探究。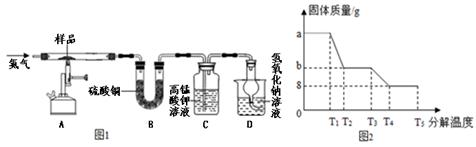
(3)装置B中硫酸铜粉末变蓝,说明产物中有 ,称量反应后装置B,增重12.6g
(4)装置C中 ,说明产物中还有SO2。
查阅资料得知二氧化硫气体能与高锰酸钾溶液发生如下反应:
5SO2 + 2KMnO4 + 2H2O X + 2MnSO4 + 2H2SO4 ,则X的化学式是 。
(5)硫酸亚铁晶体完全分解后装置A中固体呈红棕色,放入足量稀盐酸,固体全部溶解,得到黄色溶液,则装置A中红棕色固体是 。
(6)D装置中球形干燥管的作用是 ,氢氧化钠溶液的作用是 。
(7)反应结束后还要不断的通入氮气直至冷却,其目的是 。
【数据处理】
兴趣小组同学利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量--分解温度的关系图(图2)
①根据图2中有关数据,可计算出FeSO4•xH2O中的x值是 (要求写出计算过程)。
②从理论上分析得出硫酸亚铁分解还生成另一物质SO3,请写出T3—T4段发生反应的化学方程式 。
③上述试验中若将装置B和装置C进行调换,则测得FeSO4•xH2O中的x值会 (填“偏大”“偏小”或“不变”)
A、B、C分别是Zn、Cu、Ag三种金属中的一种。为了从它们的混合物中分离
出金属A,并获得B和C的盐,进行如下实验操作:
请回答以下问题: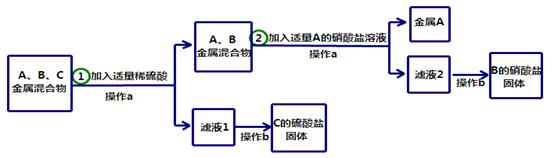
写出步骤①中发生反应的化学方程式 .
A、B、C三种金属的活动性顺序是 > > .
操作b都需要用到玻璃棒的作用是 .
金属A是 (填化学式,下同),B的硝酸盐是 。
把13克的锌投入到98克稀硫酸中恰好完全反应,求生成的氢气的质量是多少?
以下是甲、乙两同学对有关镁与盐酸反应的系列研究。
研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:
(1)反应中试管外壁发烫,说明镁与稀盐酸反应是 反应(填
“吸热”或“放热”)。
(2)实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,
则t1~t2时间内反应速率逐渐加快的主要原因是 。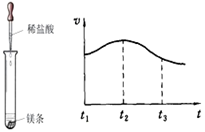
研究二:反应后所得溶液的酸碱性探究:
(3)甲同学反应后用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶
液呈 性(选填“酸”“碱”或“中”)。
甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;猜想Ⅱ:氯化镁溶液pH小于7。为
验证猜想,甲同学需测定 溶液的酸碱性,实验表明该溶液显弱酸性。
(4)乙同学重复甲同学实验时,发现反应后所得试管中溶液pH大于7。发现实验与甲同学实
验不同的是,反应后的试管中镁条有剩余。乙同学猜想可能是镁与热水反应生成了碱性
物质。乙同学为验证猜想,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶
液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,
请根据实验现象写出镁与水反应的化学反应方程式 。
(5)金属氯化物溶液pH值大小与金属的活动性有关,如氯化钠溶液显中性,氯化镁溶液显弱酸性,则氯化钾溶液显 性。
(6)活泼金属能与水在一定条件下反应。实验发现钠与冷水剧烈反应,产生大量的气体。由
此可见金属与水反应与金属的活动性顺序 (填“有关”或“无关”)。
研究三:金属活动性强弱与原子结构的关系:
下图为镁原子、钙原子和钡原子结构示意图。已知其中Ba的活动性最强,据此推测,金属的活动性除与原子的最外层电子数有关,还与 有关。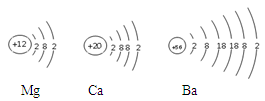
研究四:确定镁条的成分:
称取3.2g表面被氧化的镁条, 放入100g稀盐酸中恰好完全反应,生成气体0.2g。求:
(7)此镁条中金属镁的质量。(写出计算过程,共3分)
(8)反应后所得溶液中溶质的质量分数 。(计算结果保留一位小数)
有①Cu-Zn ②Cu-Ag 两种貌似黄金的合金,它们都有其特殊的用途,但一些骗子常用它们做成饰品冒充真黄金欺骗消费者。对此,化学科学有责任加以揭露。
(1)现有上述两种合金制成的假黄金饰品各一件,小明同学只用稀盐酸和必要的实验仪器就鉴别出其中一种饰品是假黄金,它是合金 (填写代号);若要证明另一种饰品也是假黄金,可选用一种盐溶液来验证,这种盐可以是
(写一种盐的名称或化学式);
(2) 取与上述用稀盐酸鉴别出的同种合金10g,放入烧杯中,再向其中加入93.7g某稀盐酸恰好完全反应后,测得烧杯内剩余物质的质量共为103.5g。
①上述过程中变化的质量10g+ 93.7g -103.5g=0.2g是 (填物质的名称或化学式)的质量;
② 10 g,该合金中铜的质量是多少?