[北京]2011届北京市大兴区中考一模化学试卷
森林失火时,灭火队员通常要砍伐一些树木,开辟”防火隔离带”,其主要目的是
| A.隔离空气 | B.隔离可燃物 | C.降低可燃物温度 | D.开辟运输水的道路 |
下列化学方程式书写正确的是
| A.C + O2 ="=" CO2 | B.2H2O ="==" O2↑+ 2H2↑ |
| C.H2SO4+NaOH==NaSO4+H2O | D.4P + 5O2  2P2O5 2P2O5 |
在元素周期表中,镁元素的某些信息如图所示,下列说法不正确的是
| A.镁元素属于非金属元素 | B.镁元素原子的核电荷数为12 |
| C.镁元素原子的核外电子数为12 | D.镁元素的相对原子质量为24.31 |
下列物质的用途中,利用其物理性质的是
| A.氧气用于气焊 | B.硫酸用于除铁锈 |
| C.干冰用于人工降雨 | D.小苏达用于治疗胃酸过多 |
用右图所示的简易净水器处理浑浊的河水,下面对该净水器分析正确的是
| A.能杀菌消毒 | B.净化后的水属于纯净物 |
| C.活性炭的主要作用是吸附 | D.能将硬水变为软水 |
下列关于Na、Na+ 两种粒子的判断中,正确的是
①核电荷数相等 ②核外电子数相等 ③电子层结构完全相同 ④质量几乎相等 ⑤质子数相等 ⑥ Na+比Na稳定
| A.①④⑤ | B.①③⑤⑥ | C.①④⑤⑥ | D.②③④ |
“绿色化学”能实现零排放(即反应物中的原子利用率达到100%)。CO与H2在一定条件下按照不同的比例可以合成不同的有机化工原料。根据零排放的要求,以CO和H2合成的有机物不可能是
| A.甲醇(CH4O) | B.乙醇(C2H6O) | C.甲醛(CH2O) | D.乙酸(C2H4O2) |
过氧乙酸常用来配制消毒液,过氧乙酸的化学式为C2H4O3。下列叙述中正确的是
| A.过氧乙酸是由9个原子构成的 |
| B.过氧乙酸的相对分子质量为76 g |
| C.过氧乙酸中碳、氢、氧元素的质量比为6∶1∶12 |
| D.一个过氧乙酸分子中,碳、氢、氧原子的个数比为1∶2∶3 |
鉴别下列各组物质,括号中选用的试剂或方法,不正确的是
| A.羊绒和腈纶(抽丝灼烧) | B.NaOH溶液和稀H2SO4 (酚酞溶液) |
| C.Ca(OH)2溶液和NaOH溶液(稀盐酸) | D.KMnO4 和CaCO3 (观察颜色) |
甲、乙两物质的溶解度曲线如图所示,下列叙述中正确的是
| A.t1℃时,甲和乙的饱和溶液中溶质的质量分数相等 |
| B.t1℃时,甲、乙各30g分别加入70g水中均能恰好完全溶解 |
| C.t2℃时,在l00g水中放入60g甲,所得溶液溶质的质量分数为37.5% |
| D.将t1℃时甲和乙的饱和溶液同时升温至t2℃,甲溶液的溶质质量分数将比乙的大 |
下表列出了除去物质中所含少量杂质的方法,其中错误的是
| |
物质 |
所含杂质 |
除去杂质的方法 |
| A |
CO2 |
CO |
点燃 |
| B |
NaCl |
泥沙 |
溶解、过滤、蒸发 |
| C |
Cu(NO3)2溶液 |
AgNO3 |
加入过量的铜粉,过滤 |
| D |
NaOH溶液 |
Na2CO3 |
加入适量的氢氧化钙溶液,过滤 |
右图是某燃煤发电厂处理废气的装置示意图。下列说法正确的是
①此过程中没有发生分解反应
②此过程中S元素的化合价未发生改变
③使用此废气处理装置可减少酸雨的形成
④整个过程的反应可表示为:SO2+CaCO3 ="==" CaSO4 + CO2
| A.③ | B.①③ | C.②③④ | D.③④ |
向一定溶质质量分数的蔗糖溶液中加入10g蔗糖,完全溶解后,得到溶质质量分数为30%的蔗糖溶液100g。则原蔗糖溶液溶质质量分数约为
| A.10% | B.11% | C.20% | D.22% |
家庭厨房就是一个化学小世界,“锅碗瓢盆”和“柴米油盐酱醋茶”中包含着许多化学知识。
(1)下列厨房用品所使用的主要材料,属于金属材料的是 (填写字母序号,下同);属于有机合成材料的是 。
A.紫砂锅 B.陶瓷碗 C.不锈钢水瓢 D.塑料盆
(2)家用天然气中常添加一种具有特殊气味的物质乙硫醇。当天然气泄露时,会闻到该气味,说明分子是 。
(3)小明家某天午饭的食谱是:米饭、炖牛肉、炒油菜、西红柿鸡蛋汤。其中含有的营养素有糖类、 、维生素、油脂、水和无机盐。
(4)味精是烹制菜肴的调味品,味精的鲜味与溶液的酸碱度有关,当pH为6-7时鲜味最强;味精的鲜味还与温度有关,其水溶液经120℃以上长时间加热,不仅鲜味消失,而且生成对人体有害的焦谷氨酸钠。据此,下列认识正确的是______。
A.味精应避免在酸性或碱性较强的条件下使用
B.谷氨酸钠在加热条件下生成焦谷氨酸钠是物理变化
C.菜烧熟起锅后再放味精比炒菜过程中加入味精更有利于人体健康
2010年12月14日下午,以“低碳生活”为主题的专题展览在中国科技馆正式开展。本次展览旨在引导公众改变生活观念,减少二氧化碳排放。展览共设5个分主题展区。
(1)地球村的“碳”危机,展示人类过度开发、高碳排放所造成的恶果,如温室气体产生的温室效应。二氧化碳、氧化亚氮(N2O)、甲烷和臭氧(O3)是地球大气中主要的温室气体,其中甲烷的化学式为 。
(2)自然界的“碳”循环。使用各类化石燃料可向大气中释放二氧化碳,化石燃料包括 、石油、天然气。 植物通过光合作用从空气中吸入二氧化碳,请将下列光合作用化学方程式补充完整:6CO2 +  C6H12O6 + 6O2
C6H12O6 + 6O2
(3)你和我的“碳”足迹。“碳足迹”就是指一个人的能源意识和行为对自然界产生的影响。它有一定的计算方法,如乘坐飞机长途旅行二氧化碳排放量(Kg)=公里数×0.139,若乘飞机旅行2000公里所排放的二氧化碳,需要种 棵树来补偿(按每棵树能吸收111Kg二氧化碳来计算)。 
(4)高科技的减“碳”术。为限制二氧化碳等温室气体的排放量,科学家采取“组合转化”技术,将二氧化碳和氢气在催化剂和加热条件下转化为一种重要的化工原料乙烯(C2H4)和水,该反应的化学方程式为 。
(5)新生活的低“碳”路。下列符合低碳生活理念的是 (填字母序号)。
| A.少买不必要的衣服 | B.使用节能电器 |
| C.洗碗时不间断地放水冲洗 | D.少开私家车,多乘公共交通工具 |
建立宏观、微观和符号之间的联系是化学学科的特点。
(1)构成氯化钠的基本微粒是 (填“分子”、“原子”或“离子”)。
(2)用符号表示下列微粒。2个氧原子 ;3个钠离子 。
(3)A、B、C、D表示4种物质,其微观示意图见下表。A和B在一定条件下反应可生成C和D。下列说法正确的是 (填数字序号)。
①4种物质均由分子构成
②该反应属于置换反应
③C、D两种物质的质量比为11:7
④4种物质中属于氧化物的是A、B
⑤若有28gA完全反应,则有14g D生成
人类的生产生活离不开金属。
(1)金属铁、铝常用来制作炊具,主要是利用其 。
(2)人类每年从自然界提取大量的金属,其中提取量最大的是铁。用赤铁矿(主要成分为Fe2O3)和一氧化碳炼铁的化学方程式为 。
(3)我国钢铁年产量很高,但因锈蚀造成的损失也很惊人。右图是探究铁生锈条件的装置,据图回答问题:
一段时间后可观察到的现象是 ,由此说明铁生锈的条件是 。
(4)从含有CuSO4、ZnSO4、FeSO4的废水中回收重要原料硫酸锌和有关金属,实验过程如下:
请回答:
固体丙的化学式为 ;写出步骤①中反应的化学方程式 。
A~F是初中化学常见物质。
(1)A与水反应生成B,该反应能放出大量的热。A的俗称是 。
(2)C与D反应生成E和水,E是日常生活中常用的调味品。E的化学式为 ,该反应的基本反应类型为 。
(3)B与F反应是工业制D的方法。该反应的化学方程式为 。
(4)用B、C、D、E、F溶液进行实验,取其中两种溶液混合(不发生化学反应),再加入剩余溶液中的一种,生成气体(或沉淀)的质量与所加溶液的质量关系如下图所示。
①若产生如图1所示的现象,且混合溶液中的两种溶质均由三种元素组成。写出有关反应的化学方程式 。
②若产生如图2所示的现象,在下表中填写混合溶液及所加溶液中溶质的化学式。
| 混合溶液 |
所加溶液 |
| |
|
| |
|
| |
|
| |
|
根据下图回答问题。 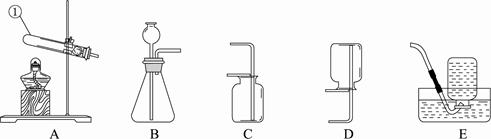
(1)写出标有序号的仪器名称:① 。
(2)实验室制取二氧化碳应选用的装置为 (填字母号,下同)。
(3)用高锰酸钾制取氧气的化学方程式为 ,应选用的发生装置为 。
(4)实验室用过氧化氢溶液制氧气时要加入二氧化锰,二氧化锰的作用是 。
下面是某兴趣小组同学做的3个小实验。根据实验内容回答下列问题。
| 序号 |
实验装置 |
实验操作 |
实验现象、解释或结论 |
| (1) |
 |
①关闭活塞K,给木炭加热。 ②熄灭酒精灯,待木炭冷却后,打开活塞K,通入氧气。 ③点燃酒精灯,给木炭加热。 |
①木炭不燃烧。 ②木炭不燃烧。 ③木炭燃烧。 由此说明可燃物燃烧的条件是 。 |
| (2) |
 |
打开分液漏斗的玻璃塞和活塞K,将稀硫酸注入小试管中。 |
观察到的现象是 ,由此说明二氧化碳的性质是 。 |
| (3) |
 |
打开分液漏斗的玻璃塞和活塞K,将水注入人字形管中。 |
观察到的现象是 ,出现此现象的原因是 。 |
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究。
【查阅资料】
①NaN3受撞击会生成Na、N2。
②NaN3遇盐酸、H2SO4溶液无气体生成。
③碱石灰是CaO和 NaOH的混合物。
④NaN3的制备方法是:将金属钠与液态氨反应制得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和氨气(NH3)。
【问题探究】
(1)汽车经撞击后,30毫秒内引发NaN3迅速分解,写出该反应的化学方程式 。
(2)工业级NaN3中常含有少量的Na2CO3,其原因是(用化学方程式表示) 。
(3)为测定某工业级NaN3样品中含有Na2CO3的质量分数,化学小组同学设计了如下实验装置。
①小明同学认为通过测定装置Ⅰ中反应前后B的质量差,再通过相应计算,就可测定Na2CO3的纯度,小组内同学通过讨论认为不可以,其理由可能是 。ⅠⅡ
②小刚同学在大家讨论的基础上,设计了装置Ⅱ。请分析:装置Ⅱ中A的作用是_____;若无装置C,对测定结果造成的影响是 (填“偏大”、“偏小”或“无影响”);装置E的作用是 。
③根据装置Ⅱ,小组同学设计的实验步骤有:a.称量装置D。b.称量样品,检查装置气密性。c.打开弹簧夹,鼓入空气。d.打开分液漏斗的活塞和玻璃塞,注入足量的稀硫酸,关闭活塞和玻璃塞。其正确顺序为 (填字母序号,可重复)。
在今年全国两会期间,代表们所使用的石头纸、环保手提袋和购物袋,主要原料是具有环保意义的碳酸钙。为测定某石头纸中碳酸钙的含量,某同学称取10g碎纸样品放入烧杯中,将50g 盐酸分5次加入烧杯。实验数据见下表(假设纸张其他成分既不溶于水,也不与盐酸反应):
| |
第1次 |
第2次 |
第3次 |
第4次 |
第5次 |
| 加入稀盐酸的质量/g |
10 |
10 |
10 |
10 |
10 |
| 充分反应后烧杯及烧杯中物质总质量/g |
209.12 |
218.24 |
227.36 |
236.48 |
246.48 |
(1)10g样品与足量稀盐酸反应最多生成 g气体。
(2)计算样品中碳酸钙的质量分数。(写出计算过程)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号