硝酸钾溶解度随温度变化的曲线如图所示:

(1)图中
三点中属于不饱和溶液的是。
(2)由
点到
点可采取的措施。
(3)若
溶液中混有少量的
杂质,可以采取方法获得较纯净的
.
(4)若将
点溶液逐渐加水稀释使其质量分数降至10%,在此稀释过程中符合此溶液中溶质质量变化的规律的图像是。

下图是小华配制100g溶质质量分数为7.5%的NaCl溶液的实验操作示意图:

(1)上图中的玻璃仪器分别是广口瓶、量筒、 和玻璃棒,其中玻璃棒在此操作中的作用是 。
(2)指出图②中的一处错误操作 。
(3)通过计算确定需要水的质量是 g,配制时应选择 (填10、50或100)mL的量筒量取所需要的水。
(4)下列错误操作可能导致溶液溶质的质量分数小于7.5%的是_____________(填序号)
| A.②操作中食盐与砝码放置颠倒; |
| B.①操作中有固体洒落; |
| C.⑤操作中有水溅出; |
| D.读取量筒内液体体积于视线过低; |
E、装瓶存放操作中溶液洒落。
(5)该同学在称量氯化钠药品前天平的指针偏左,则所配制的溶液的质量分数 (填“偏大”“偏小”“不受影响”)
运用溶解度表与溶解度曲线回答下列问题:
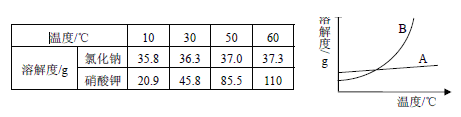
(1)氯化钠的溶解度曲线是(填"
"或"
")。
(2)
时,100
水中加入90
硝酸钾,充分溶解,所得溶液是(填"饱和"或"不饱和")溶液。当
的该溶液降温到
时,析出晶体的质量为
。
要配制100 5%的 溶液,除了需要托盘天平和量筒外,还需要用到的一组仪器是
| A. | 烧杯、试管、玻璃棒 | B. | 烧杯、胶头滴管、玻璃棒 |
| C. | 烧杯、胶头滴管、漏斗 | D. | 烧杯、酒精灯、玻璃棒 |
实验室配制50g溶质质量分数为10%的氯化钠溶液。下列说法中错误的是
| A.实验的步骤为计算、称量、溶解、转移 |
| B.溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率 |
| C.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,并贴上标签 |
| D.量取水时,用规格为50mL的量筒量取45mL蒸馏水 |
在 100 g溶质的质量分数为5%的食盐溶液中加入5 g食盐再加100 g水,完全溶解后,溶液的质量为 ,溶质的质量为 ,溶质的质量分数为
下图是恒温下模拟海水晒盐过程的示意图,与丙烧杯溶液的溶质质量分数一定相同的是()

| A. | 甲 | B. | 甲和乙 | C. | 乙和丁 | D. | 丁 |
质量分数为30%的某溶液蒸发掉10g水后,溶液的质量分数变为40%,则原溶液的质量是
| A.30g | B.40g | C.50g | D.60g |
现有硫酸钠和硫酸镁固体混合物8 g,向其中加入一定量的氢氧化钠溶液恰好完全反应,过滤,得到2.9g沉淀和溶质质量分数为10 %的滤液。求:
(1)混合物中硫酸镁的质量分数;
(2)加入氢氧化钠溶液的溶质质量分数(计算结果精确到0.1%(。
某实验小组利用图1所示仪器配制一定溶质质量分数的氯化钠溶液。
(1)图1中缺少一种必须用到的玻璃仪器,它是
(2)图2中的操作错误是 ;若按图2操作,取用的氯化钠实际质量为 g。
(3)量取蒸馏水的体积读数如图3所示,则该实验小组原计划配制的氯化钠溶液的溶质质量分数为(水的密度为1 g/cm3) ,而实际得到溶液的溶质质量分数为
(4)在上述实际配得的溶液中加6.0g水,则溶液的溶质质量分数为
(5)在上述实际配得的溶液中加23.0g氯化钠,则溶液的溶质质量分数为 (已知:25℃时,氯化钠的溶解度是36g。计算结果均保留一位小数)
下图是小华同学用氢氧化钠固体和水配制500g溶质质量分数2.5%的NaOH溶液的操作过程,该同学在称量氢氧化钠时,先将天平调节平衡,然后在两个托盘上各放一张质量相同的纸,把药品直接放在纸上称量。
(1)根据上述实验,请回答:
①a操作的错误是 。
②下列操作中导致溶质质量分数偏低的是 (填字母)。
| A.a操作中砝码和氢氧化钠放错盘 |
| B.b中烧杯用水洗涤后未干燥就使用 |
| C.c操作中视线与量筒凹液面最低处保持水平 |
| D.d操作中有少量水溅出 |
(2)小华在测定所配制溶液的酸碱度时,先将pH试纸用蒸馏水湿润,再进行测定,则测的溶液的pH值______(选填“偏大”、“偏小”或“不受影响”).
(3)小华将上述溶液稀释成0.2%做电解水实验,用 检验正极产生的气体。若将100g稀释后的氢氧化钠溶液电解,实验后溶液中氢氧化钠的质量分数变为0.25%,有 g水被电解。(已知氢氧化钠可增强水的导电性,在通电前后质量不变)
下列有关溶液的说法中,正确的是
| A.溶液都是澄清、透明、无色的 |
| B.溶液都是由一种溶质和一种溶剂混合而成的 |
| C.饱和溶液中溶质的质量分数一定比不饱和溶液中溶质的质量分数大 |
| D.向100g硝酸钾的饱和溶液加入10硝酸钾固体,溶质的质量分数不变。 |
如图所示,在室温下的饱和食盐水中放了一个塑料小球。
(1)现加入少量食盐晶体,充分搅拌和静止后,在温度不变的情况下,小球在液面沉浮情况有何变化 。
(2)若要在不用外力的情况下使小球略上浮,你准备采取的具体方法是 或 。
某化学兴趣小组的同学在实验室(室温为20℃)准备将100g溶质质量分数5%的硝酸钾溶液变为10%的硝酸钾溶液。同学们经讨论后认为有三种方法可以达到目的:
(1)可以加入硝酸钾固体。你认为加入硝酸钾的质量为 g;
(2)可以蒸发水。你认为蒸发水的质量为 g;
(3)可以加入15%的硝酸钾溶液。你认为加入15%的硝酸钾溶液的质量为 g;
将60℃的硝酸钾溶液降温至20℃,有晶体析出。有关该过程的说法错误的是()
| A. | 60℃时的溶液一定是硝酸钾饱和溶液 |
| B. | 20 摄氏度时的溶液一定是硝酸钾的饱和溶液 |
| C. | 硝酸钾的溶解度随温度降低而减小 |
| D. | 硝酸钾的晶体可采用降温结晶的方法得到 |