配制50g 10%的氯化钠溶液时,操作正确的是
| A.电子天平先调零,然后放烧杯称取氯化钠固体 |
| B.用10mL量筒量取水 |
| C.将配制好的溶液装入细口瓶中,塞好瓶塞 |
| D.最后贴上标签,注上“50g 10%的氯化钠溶液” |
25℃时,向一定量不饱和KNO3溶液中逐渐加入KNO3固体,则下列图像中能正确表示此过程溶质质量变化规律的是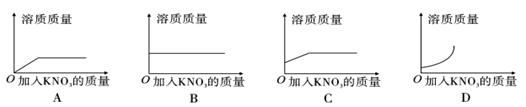
可以证实某硝酸钾溶液是20℃时的饱和溶液的事实是
| A.降温到10℃时,有硝酸钾晶体析出 |
| B.蒸发掉10g水,有硝酸钾晶体析出 |
| C.20℃时,向原溶液中加入少量硝酸钾晶体,溶液中硝酸钾的质量分数不变 |
| D.加热到30℃后,再加入硝酸钾晶体能继续溶解 |
甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是
| A.20℃时,甲溶液中溶质质量一定小于乙溶液 |
| B.20℃时,可配制溶质质量分数为30%的乙溶液 |
| C.20℃时,100 g水中加入20 g甲可得到饱和溶液 |
| D.50℃时,100 g水中加入20 g乙并降温至20℃,溶液由不饱和变饱和 |
在实验室配制质量分数一定的氯化钠溶液时,有下列图示的操作,其中肯定错误的是
向一接近饱和的KNO3溶液中逐渐加入KNO3晶体,下列图象中符合溶液中溶质质量变化规律的是
在配制10%NaCl溶液的过程中,导致溶液中NaCl质量分数小于10%的可能原因是:
①用量筒量取水时仰视读数②配制溶液是烧杯用少量水润湿③在天平的左盘称量氯化钠时,游码不在零位置就调节天平平衡,然后将游码移动到读数④盛装溶液的试剂瓶用蒸馏水润洗⑤氯化钠晶体不纯
| A.①②③④⑤ | B.①②④⑤ | C.①②③ | D.②③④⑤ |
下列叙述正确的是()
| A. | 乳酸( )中,碳氢氧三种元素的物质比是6:1:8 |
| B. | 为了加快过滤速度,用玻璃棒搅拌漏斗内的液体 |
| C. | 溶液中少量的 杂质,可用适量 溶液除去 |
| D. | 3%的 溶液中,溶质和溶剂的质量比为3:100 |
某氯化钠溶液中溶质的质量分数是20%,则下列说法中不正确的是
| A.溶质质量︰溶剂质量=1︰4 |
| B.溶剂质量︰溶液质量=4︰5 |
| C.溶质质量︰溶液质量=1︰5 |
| D.100g水中含有20g氯化钠 |
实验小组的甲、乙两同学配制溶液,甲欲配制100g 15%的氯化钠溶液,乙欲用98%的浓硫酸(ρ=1.84g/mL)配制50g 10%的稀硫酸,下列有关说法正确的是
| A.甲、乙两同学都一定用到托盘天平 |
| B.乙同学溶解时,需将水缓缓加入浓硫酸中 |
| C.乙同学需量取45g 水 |
| D.若甲同学仰视取液,所得溶液质量分数偏小 |
在配制10%的氯化钠溶液的过程中,导致溶液中氯化钠质量分数小于10%的可能原因是
①用量筒量取水时俯视读数
②配制溶液的烧杯用少量蒸馏水润洗
③在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数
④盛装溶液的试剂瓶用蒸馏水润洗
⑤氯化钠晶体不纯.
| A.①②③④⑤ | B.只有①②④⑤ | C.只有①②③ | D.只有②③④⑤ |
溶液与我们的日常生活密切相关.下列有关溶液的说法正确的是
| A. | 溶液一定是无色透明的 |
| B. | 面粉与水混合可形成溶液 |
| C. | 稀溶液液可能是饱和溶液 |
| D. | 溶液的上层浓度小,下层浓度大 |
t℃时,测得某物质(不含结晶水)在不同质量的水中溶解,达到饱和状态时所溶解该物质的质量,绘制成如图中斜线。下列说法正确是
| A.该物质的溶解度随温度的升高而增大 |
| B.t℃时该物质的溶解度为40 |
| C.M点表示溶液中溶质的质量分数为25% |
| D.图中4点表示的溶液中溶质质量分数的关系是:N<M<P=Q |
下图是A、B两种物质的溶解度曲线,下列说法正确的是
A.t1℃时,A、B两种溶液的溶质质量分数相等
B.t2℃时,B的饱和溶液温度升高或降低均析出晶体
C.t2℃时,B的饱和溶液升温后会变为不饱和溶液
D.将A的饱和溶液恒温蒸发水,溶质质量分数变大