将一定质量的镁、铝合金(不含其他物质)与足量的稀硫酸充分反应后,生成0.2g氢气,原混合物的质量不可能是
| A.1.2g | B. 2.0g | C.2.2g | D.1.9g |
(丰台25)一定质量的稀硫酸和氢氧化钠溶液恰好完全反应,所得溶液中溶质质量分数为10%,则溶液中钠离子和水分子的个数比为
| A.1﹕71 | B.2﹕71 | C.1﹕79 | D.2﹕79 |
(东城21)在不同温度下,CO可将Fe2O3还原为Fe3O4、FeO或Fe,下列有关说法不正确的是
| A.生成固体的质量一定小于固体反应物的 |
| B.在实验室完成此实验,一定要对尾气进行处理 |
| C.一定量的Fe2O3还原为FeO时,消耗的CO最多 |
| D.生成的气体能使澄清石灰水变浑浊,该气体一定是CO2 |
某固体混合物由Mg和MgO组成,取该混合物6.4g与一定量稀硫酸恰好完全反应(反应后溶液中无晶体析出),所得溶液中溶质的质量为24g,则原混合物中氧元素的质量为
| A.4.8g | B.3.2g | C.2.56g | D.1.6g |
高温加热碳酸钙可制得生石灰和二氧化碳,现高温加热10g碳酸钙,一段时间后停止加热,测得剩余固体中钙元素的质量分数为50%。此时反应生成的二氧化碳质量为
| A.4.4克 | B.2克 | C.2.4克 | D.4克 |
(平谷25)肾病患者需要食用低钠盐的食品。目前,市场供应的低钠盐多为苹果酸钠盐(C4H5O5Na)。每日食用5g苹果酸钠盐,人体摄入的钠元素质量仅为等量食盐中钠元素质量的
| A.18.7% | B.26.7% | C.37.5% | D.43.1% |
现有一样品,经分析含氧化钙、碳酸钙两种物质。向该样品中加入溶质质量分数为7.3%的稀盐酸100g,恰好完全反应得到溶液,(已知 ),蒸干该溶液得到固体质量为
),蒸干该溶液得到固体质量为
| A.11.1g | B.22.2g | C.7.3g | D.14.6g |
在10g碳酸钙固体高温煅烧一段时间,冷却后投入足量稀盐酸中完全反应。有关结论错误的是()
| A. | 共生成0.1mol氯化钙 | B. | 燃烧越充分则消耗的盐酸量越少 |
| C. | 共生成0.1mol二氧化碳 | D. | 燃烧后固体中氧元素的质量分数减小 |
向一定质量的硫酸铜溶液中加入不同质量的铁粉所呈现的信息如下表:
| Fe质量/g |
5.6 |
11.2 |
16.8 |
22.4[来 |
| Cu质量/g |
6.4 |
12.8 |
19.2 |
22.4 |
根据信息,下图所示关系正确的是
溶液的碱性强弱跟溶液中 的数量有关;一定体积的溶液中
的数量有关;一定体积的溶液中 数量越多,则溶液的碱性越强。同体积的10%的NaOH溶液与10%的KOH溶液(溶液密度相同)相比,碱性更强的是
数量越多,则溶液的碱性越强。同体积的10%的NaOH溶液与10%的KOH溶液(溶液密度相同)相比,碱性更强的是
| A.NaOH | B.KOH | C.一样强 | D.无法比较 |
某石灰石样品中含有不含钙元素的杂质,测得该石灰石样品中含钙的质量分数为36%,该样品中碳酸钙的质量分数为( )
| A. |
36% |
B. |
40% |
C. |
72% |
D. |
90% |
根据下面的实验过程和提供的数据,可知样品中碳的质量分数为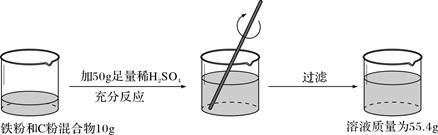
| A.44% | B.46% | C.54% | D.64% |
铅蓄电池放电时反应的化学方程式为Pb+PbO2+2H2SO4="=" 2PbSO4+2H2O,当有23.9 g PbO2反应时生成水的质量是多少?
氢氧化钠固体易吸收空气中的二氧化碳而变化。取4.65g已部分变质的氢氧化钠固体跟36.5g 10%的盐酸恰好完全反应后,将溶液蒸干,所得固体的质量是
| A.11.7g | B.5.85g | C.4.65g | D.8.3g |
取一定量的氧化铁与氧化铜的混合物,加入溶质质量分数为9.8%的稀硫酸100g,恰好完全反应生成盐和水.原混合物中氧元素的质量是( )
| A.6.4g | B.3.2g | C.1.8g | D.1.6g |