下图是实验室常用的装置,请回答下列问题:
⑴写出仪器①的名称 。收集某气体能采用E装置,由此推测该气体具有的
性质是 。
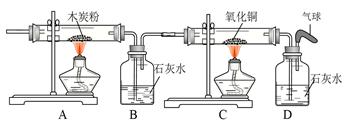
⑵实验室制备并收集氧气的装置组合是 (填装置序号),反应的化学方程式为 ;若用F装置收集该气体,则气体应从 端进入(填“a”或“b”);装置A、B都可以用来制取二氧化碳,比较这两个装置,指出A装置的一个突出优点是 。
⑶实验室制得的CO2气体中常含有HCl和水蒸气,为了得到纯净、干燥的CO2气体,除杂装置的导管气流方向连接顺序是 (填选项字母编号)。
A.c→d→e→f B.d→c→e→f C.e→f→c→d D.f→e→d→c
(4)将氧气通入如下图所示的装置,实验中观察到B中澄清石灰水变浑浊,C中黑色固
体变为红色,则进入装置B的气体一定含有 ,B处发生反应的化学方程式是 。
⑸实验室制取氧气时常用二氧化锰作催化剂。某二氧化锰样品中含有杂质炭,为测定该样品中二氧化锰的质量分数,某兴趣小组设计的实验方案是:在一定量的样品中通入干燥纯净的氧气,使杂质炭在加热条件下反应生成CO2来进行分析测定。
①如下图所示是用干燥纯净的氧气与样品反应来测定二氧化锰质量分数的装置,仪器②中装有碱石灰(氧化钙和氢氧化钠的混合物),其作用是 。
②为验证装置①已将CO2吸收完全,可在装置①与②之间加入
装置进行证明。
③现称取5.0 g二氧化锰样品进行实验,装置①反应前后的质量差为1.1g,则样品中二氧化锰的质量分数为多少?(写出计算过程)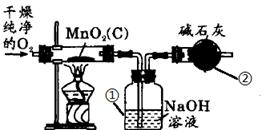
现有一瓶硫酸溶液,为测定其溶质的质量分数,取该溶液98g于烧杯中,逐渐加入足量的氯化钡溶液,反应中物质间的质最关系如右图所示。请计算:
(1)原硫酸溶液中溶质的质量分数。
(2)若取一定量该硫酸溶液配制509溶质的质量分数为7%的稀硫酸,需加人水的质量是多少?

已知碳酸氢钠在
左右就能分解为碳酸钠、水和二氧化碳,而碳酸钠受热不分解.现有某工厂生产出的一批碳酸氢钠中混有少量的碳酸钠,为了测定产品中碳酸氢钠的质量分数,具体的检验步骤如下:
①取一只洁净的坩埚,称其质量为
;再向其中加入样品。称得总质量为
;
②加热该盛有样品的坩埚;
③将坩埚充分冷却,称量坩埚和剩余固体的质量;
④多次重复步骤②和③至恒重,称得坩埚和剩余固体的总质量为
。
(1)写出碳酸氢钠受热分解的化学方程式。
(2)用(填仪器名称)将加热后的坩埚放到中(填序号)冷却。
| A. |
|
B. |
|
C. |
|
D. |
|
(3)根据题意,用
、
、
的代数式表示样品中碳酸氢钠的质量分数为。
(4)步骤①、③和④都需要用到精度为
的托盘天平称量,若本题中
的值超过
,假设样品中碳酸氢钠的质量分数为
,则至少需称样品多少克?
新冠肺炎疫情期间,可用体积分数为75%的乙醇(C2H5OH)消毒液进行手和其他皮肤的消毒。如图为某品牌乙醇消毒液的标签。(纯乙醇的密度约为0.8g/mL,水的密度约为1.0g/mL)。
请回答下列问题:
(1)H2O的相对分子质量为 ,H2O分子中H原子与O原子的个数比为 。
(2)乙醇由 元素组成,配制乙醇消毒液需要乙醇和水的体积比为 。
(3)乙醇消毒液中乙醇的质量分数约为多少?(要求写出计算过程,结果精确到0.1%)

(7)向25.8g含有少量氯化钠杂质的碳酸钠白色固体中,慢慢加入10%的稀盐酸到恰好不在产生气体为止,共收集到气体8.8g。白色固体中碳酸钠的质量是多少?所得溶液中氯化钠的质量分数是多少?
某化学兴趣小组为了测定一工厂废水中硫酸的含量,取100g废水于烧杯中,加入120g质量分数为10%的氢氧化钠溶液,恰好完全反应(废水中无不溶物,其它成份不与氢氧化钠反应)。请计算废水中硫酸的质量分数。
小明测得石灰石与一定量的稀盐酸反应后的溶液PH为2,也适量该溶液向其中逐滴加入碳酸钠溶液,并测得溶液PH随加入碳酸钠溶液体积的变化曲线如下图所示。
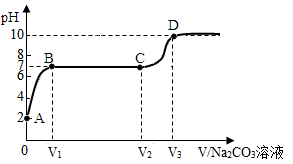
请回答下列问题:
(1)A点处溶液中的两种溶质是(写化学式);
(2)AB段可观察到的实验现象是 ;
(3)BC段发生反应的化学方程式是 ;
(4)CD段PH上升的原因是;
如图是实验室所用盐酸试剂瓶上标签的部分内容,请仔细阅读后计算:(1)用60mL的浓盐酸可以配制溶质质量分数为10%的盐酸 则他至少每天要喝多少毫升牛奶?
B:(第1,2小题各1分,第3小题2分)
(2)利用刚配好的盐酸测定某二价金属(R)的纯度:他取8克该不纯金属粉末(所含杂质不与酸反应,也不溶解于水)再取刚配好的盐酸溶液73克混合至恰好完全反应后过滤,将滤液蒸干,得到粉末状固体的质量为13.6克.
①金属R发生反应的化学方程式 ;
②利用已知条件求解反应生成氢气的质量(x)比例式 ;;
③该金属的纯度 ;
④若反应后的溶液只含有一种溶质,向反应后的溶液中加入56.7克水,则此时溶液中溶质质量分数 .
向盛有22.3 g Na2CO3和NaCl固体混合物的烧杯中加入216.1 g稀盐酸恰好反应,反应过程用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如下图所示:烧杯连同药品的起始质量为300 g。回答下列问题: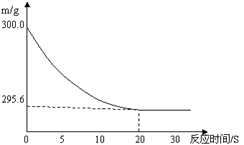
(1)当固体混合物与稀盐酸恰好完全反应时,所需时间约为 S。
(2)完全反应后,产生二氧化碳气体质量 g。
(3)反应后,得到室温下的不饱和溶液。所得溶液中溶质的质量分数为多少?
有3g混有碳酸钠的氯化钠固体样品,向其中滴加盐酸,加入盐酸的质量与生成二氧化碳气体的质量符合如图所示的质量关系.(不计损耗)
(1)样品完全反应后,共放出二氧化碳气体的物质的量为 mol。
(2)计算样品中氯化钠的质量分数。(根据化学方程式列式计算)
人体缺乏维生素C(简写Vc)会患坏血病。下图所示为某种“维生素C”说明书的一部分,请回答:
(1)Vc中C、H、O三种元素的质量比是 。
(2)若正常成人每天对Vc的最低需要量为60mg。
①当这些Vc完全来自右图的“维生素C”时,则每次服用“维生素C”至少 片;
②当这些Vc完全来自某种新鲜蔬菜(每1000g这种蔬菜含Vc120mg)时,每天至少应食用这种蔬菜 g。
③维生素C又名抗坏血酸,其水溶液能使紫色石蕊试液变 色。
我国青海湖采集的天然碱样品可表示为aNa2CO3·bNaHCO3·cH2O(a、b、c为最简整数比)。小红同学为测定其组成,称取该天然碱样品16.6g进行如下实验: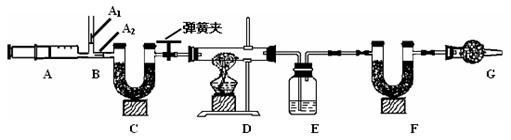
已知:1.碳酸钠比较稳定,加热时不分解 ;2. 2NaHCO3 Na2CO3 +CO2 ↑ +H2O
Na2CO3 +CO2 ↑ +H2O
3.图中B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,A1打开进空气,A2关闭。
实验步骤
实验时,组装好装置,实验前应先 ,然后,实验步骤是:
① 反复推拉注射器 ② 称量E、F的质量 ③ 关闭弹簧夹,加热D处试管直到反
应不再进行 ④ 打开弹簧夹,再次反复缓缓推拉注射器 ⑤ 再次称量E、F的质量。
(二)问题探究:
(2) E中的药品为 ,E的作用是 。C、F、G中装有碱石灰(生石灰与烧碱的固体混合物),则C的作用是 , F的作用是 。写出 F装置中所发生反应的一个化学方程式 。
(3)实验步骤②与③能否颠倒 (填“能”或“不能”)。若不进行步骤④的操作,则所测得的碳酸氢钠质量 (填“偏大”、“偏小”、“无影响”), 该操作中推注射器时缓缓的目的是 ;若没有G装置,则碳酸氢钠的质量 (填“偏大”、“偏小”、“无影响”)。
(4)下表是实验记录数据:
| 反应前 |
反应后 |
| E的质量为100.0g |
E的质量为102.25g |
| F的质量为50.0g |
F的质量为51.1g |
则: ① 碳酸氢钠分解生成二氧化碳的质量为 g
② 碳酸氢钠的质量为 g
③ 该天然碱的化学式中a:b:c= 。
【10新疆20】.作物的无土栽培可以显著提高产品的产量和质量。某茄子的无土栽培营养液中含有7%的KNO3。
(1)KNO3属于 (选填“复合肥料”、“氮肥”“钾肥”或“磷肥”)。
(2)要配制150kg该营养液,需要KNO3的质量 kg。
不同年龄段的人群每天钙的适宜摄入量不同,哺乳期妇女每日推荐摄入量为1200mg,右图为某保健品说明书的一部分,请回答:
(1)维生素D3的化学式为C27H44O ,则维生素D3中C、H、O三种元素的质量比是 。
(2)假设某哺乳期妇女每天服用“钙尔奇”1片,则能补充 mg的钙(“钙尔奇” 中除碳酸钙外其他成分不含钙元素)。
新型材料纳米级
粉具有广泛的用途,它比普通
粉更易与氧气反应,其制备工艺流程如下图所示:
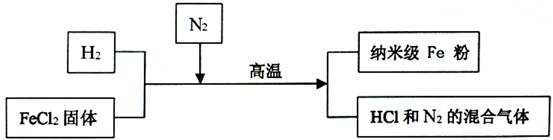
请回答下列问题:
(1)纳米级
粉在氧气中能自发燃烧生成黑色固体,此黑色固体的化学式为 。
(2)请补充完成上述制备工艺的化学方程式:
。 在制备纳米级
粉的工艺流程中,
的作用是。
(3)研究人员发现最后制得的纳米级
粉样品中混有少量的
杂质。
①为除去样品中的杂质,在无氧环境下,先加 溶解,然后再、洗涤、烘干.
②取样品20g,加入足量的盐酸,生成氢气0.7g。请计算该样品中单质
的质量分数。
(请写出计算过程)。