一定质量的碳酸钠和氯化钠固体混合物,加入101 克水完全溶解后,再往其中加入100
氯化钙溶液,恰好完全反应。过滤,将滤渣干燥,称得其质量为10
,测得滤液中溶质的质量分数为10
。试计算:
(1)100
氯化钙溶液中溶质的质量。
(2)原固体混合物中碳酸钠的质量分数。
黄铜是一种常见的合金材料,其作用成分为
、
,还含有少量不与酸反应的成分.现向一定质量的黄铜中加入体积为100mL,密度ρ=1.2g/mL的稀硫酸,产生
的质量和硫酸溶液体积的关系如图所示.充分反应后溶液中剩余固体的质量为27g。

(1)观察图象,黄铜与硫酸充分反应后,硫酸是否有剩余?(选填"是"或"否")
(2)黄铜中
的质量分数为多少?(请列式计算,结果精确到0.1%)
(3)若往反应后的溶液中滴加26%的
溶液至恰好不再产生沉淀时,共消耗
溶液400g,则原硫酸溶液的质量分数为多少?(请列式计算,结果精确到0.1%)
有一包含有碳酸钠和碳酸氢钠的混合物,为了测定其含量,技术员小颖取19g样品放入烧杯中,加入100g水充分溶解后,逐滴滴入稀盐酸并不断搅拌,至B点时恰好完全反应。测出烧杯内溶液的总质量与加入稀盐酸质量的关系曲线如图所示(反应生成的气体全部逸出)。已知碳酸钠与稀盐酸反应分两步进行:
第一步反应:
第二步反应:
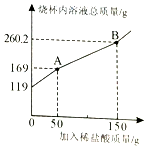
求:(1)图中AB段表示第步反应;反应后生成的二氧化碳质量是g.
(2)所加入的稀盐酸中溶质质量分数是多少?
(3)样品中碳酸氢钠的质量是多少?
某化学兴趣小组对某铜锌合金样品进行探究实验.称取样品10.0克,再用100.0克稀硫酸溶液逐滴滴入,实验情况如图所示.求:
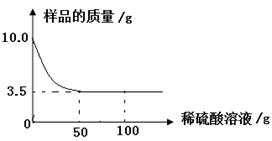
(1)铜锌合金汇中,
的质量分数是.
(2)所用稀硫酸溶液中溶质的质量分数是多少?
小芳在实验室用石灰石和稀盐酸制取了二氧化碳,并对实验产生的废液进行溶质成分鉴定:取废液上层清液50克,滴加质量分数为26.5%的碳酸钠溶液,出现气泡,滴加至10克开始出现白色沉淀,继续滴加至沉淀不再产生,过滤,洗涤,干燥,称得沉淀质量为5克,并绘制了图象,如图:
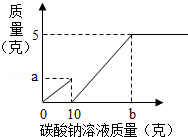
(1)图象中的a点数值
(2)废液中含有的溶质是 (写化学式)
(3)通过计算说明,图象横坐标中b点表示的溶液的质量是多少?
镁是一种活泼性较强的金属,在空气中易发生缓慢氧化,表面呈灰黑色。
(1)镁与氧气的反应属于(填基本反应类型)。要观察金属镁的颜色,需将镁条如何处理。
(2)若30
镁条存放一段时间后,质量变为了34
,则参加反应的氧气为
(假设镁只与氧气反应)。若将上述氧化前和氧化后的镁条分别与足量稀硫酸反应,生成硫酸镁的质量关系是前者后者(填">"、"="或"<")。
(3)将2.4
未氧化的镁加入到97.8
的稀硫酸中,恰好完全反应。求反应后所得溶液的溶质质量分数(假设反应过程中水分未损失)。
食盐因含有氯化镁而易潮解,现有只含氯化镁杂质的食盐10g,将其置于烧杯,加30g水溶解,得40g溶液.再向其中加入未知溶质质量分数的氢氧化钠溶液10g,充分反应后,烧杯内剩余溶液为48.84g。
(1)问生成沉淀的质量;
(2)求反应后溶液中溶质的质量分数.
7.0g含杂质的铁粉样品与足量稀硫酸反应,产生氢气的物质的量与时间关系如图所示(杂质不与酸发生反应)。计算样品中所含铁的质量分数(根据化学方程式列式计算)。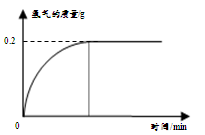
取盐酸与氯化铜的混合溶液27g放入烧杯中,逐滴滴入质量分数为20%的
溶液,产生沉淀质量与滴入
溶液质量的关系如图所示。
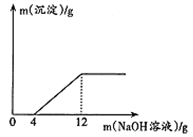
(1)滴入
溶液的质量在0~4g时,发生反应的化学方程式为;
(2)与氯化铜反应的
的质量为g;
(3)原盐酸与氯化铜的混合溶液中氯化铜的质量分数(写出计算过程).
某补钙药剂说明书的部分信息如图所示,现将用20片该药剂制成的粉末与40盐酸混合(其他成分不与盐酸反应),恰好完全反应后称得剩余物的质量为55.6
,请回答下列问题(计算请写出过程):

(1)青少年缺钙易出现的疾病是;
(2)该品牌补钙药剂每片含
的质量为多少?
(3)该盐酸中溶质的质量分数是多少?(精确到0.1%)
某碳酸钠样品含有少量的硫酸钠,取一定质量的该样品,完全溶解在水中配制成
溶液,将其全部加入到
一定质量分数的硫酸溶液中,恰好完全反应,生成的气体全部逸出后,所得溶液质量是
,将溶液蒸干,得到
硫酸钠。
计算:
(1)加入的硫酸溶液的溶质质量分数;
(2)原碳酸钠样品中碳酸钠的质量分数(计算结果精确到0.1%)。
Na2CO3中往往会含有少量的NaCl,现在一烧杯中盛有20.4g的固体混合物,向其中逐渐滴加溶质质分数为10%的稀盐酸。放出气体的总质量与所滴入稀盐酸的质量关系曲线如下图所示,请根据题意回答问题: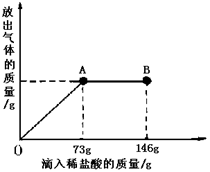
①当滴加稀盐酸至图中B点时,烧杯中溶液的pH 7(填>、=、<)。
②当滴加稀盐酸至图中A点时,烧杯中为不饱和溶液(常温),通过计算求出其中溶质的质量分数。(计算结果保留一位小数)
请根据如图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),完成下列问题:

(1)该反应产生的
气体质量为g。
(2)计算反应后所得溶液中溶质质量分数(写出计算过程)
某同学测定一瓶标签残缺的硫酸镁溶液的溶质质量分数,取30g该溶液,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液.生成沉淀的质量与所用氢氧化钠溶液的质量关系如图所示.反应方程式为:MgSO4+2NaOH=Na2SO4+Mg(OH)2↓

(1)配制100g溶质质量分数为10%的NaOH溶液,需NaOH的质量为 g.
(2)计算MgSO4溶液中溶质的质量分数(列式计算).
为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品20 g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止。反应过程中生成的气体与所用硫酸溶液的质量关系如右图所示。试计算:
(1)样品中铜的质量分数;(3分)
(2)反应所消耗的硫酸溶液质量;
(3)反应后所得溶液中溶质的质量分数。(精确到百分之零点一)