[江苏]2012年江苏省南京市栖霞区中考二模化学试卷
第三十届奥运会将在伦敦举行,下列运动设施或器材属于金属材料的是
| A.塑胶跑道 | B.羽毛球球网 | C.海绵护垫 | D.钢制单杠 |
3《中国药典》明确规定,药用胶囊以及使用的明胶原料,重金属铬的含量均不得超过2mg/kg。有毒胶囊的重金属铬的实际含量严重超标。这里的“铬”是指
被蚊虫叮咬后,涂些含有碱性物质(如NH3·H2O)的药水,可减轻痛痒。NH3中的N元素的化合价为
| A.-3 | B.0 | C.+3 | D.+5 |
老李发现自家的农田出现土壤酸化板结现象,经查阅资料得知:是因为该农田长期施用化肥硫酸铵[(NH4)2SO4]的缘故。硫酸铵属于
| A.氮肥 | B.磷肥 | C.钾肥 | D.复合肥 |
下列各组物质在水溶液中能够共存,而且加入酚酞显红色的是
| A.NaOH 、CuSO4、H2SO4 | B.NaCl 、Na2SO4、 NaOH |
| C.NaCl 、NaNO3、 HCl | D.NH4NO3、NaOH 、H2SO4 |
下列说法中,错误的是
| A.洗涤剂可乳化餐具上的油污 |
| B.用灼烧法鉴别棉纤维和羊毛纤维 |
| C.氢氧化钠溶液可直接用作厨房清洁剂 |
| D.长期用硬水洗涤的衣物会变硬 |
根据如图所示的实验现象,下列判断错误的是 ( )
| A.①②说明物质燃烧需要氧气 |
| B.①说明白磷的着火点不高于80℃ |
| C.烧杯中的热水只起提高温度的作用 |
| D.①③说明两种可燃物的着火点不同 |
下图是某河流一年中不同时期河水的平均pH变化的折线图。 则这一年内河水酸性最强的季度是
A一季度 B二季度
C三季度 D四季度
分类法是一种行之有效、简单易行的科学方法。下表对部分物质进行的分类(甲与乙、丙、丁是包含关系)错误的是
| 选项 |
甲 |
乙、丙、丁 |
| A |
碳单质 |
金刚石、石墨、C60 |
| B |
构成物质的微粒 |
分子、原子、离子 |
| C |
化石燃料 |
煤、石油、天然气 |
| D |
常见碱 |
火碱、纯碱、熟石灰 |
A、B、C三只小烧杯内分别依次盛有一定体积的浓氨水、酚酞溶液、酚酞溶液,按下图所示进行探究活动,不能得到的结论是
A.空气不能使酚酞溶液变红
B.氨水能使酚酞溶液变红
C.碱能使酚酞溶液变红
D.氨分子在不断运动
将一定质量的镁、铝合金(不含其他物质)与足量的稀硫酸充分反应后,生成0.2g氢气,原混合物的质量不可能是
| A.1.2g | B. 2.0g | C.2.2g | D.1.9g |
南京“雨花茶”是一种绿茶,绿茶中含有单宁酸(化学式为C76H52O46),具有抑制血压上升、清热解毒等功效。下列有关单宁酸的说法正确的是
| A.单宁酸属于有机化合物 |
| B.单宁酸由碳原子、氢原子和氧原子构成 |
| C.单宁酸中氢元素的质量分数最小 |
| D.单宁酸中碳、氢、氧元素质量比为76:52:46 |
两种不含结晶水的固体物质a、b的溶解度曲线如图,下列 说法正确的是
| A.b的溶解度小于a的溶解度 |
| B.分别将t2℃时a、b两种物质的饱和溶液降温至t1℃,析出 的a的质量比b多 |
| C.要从含有少量a的b溶液中得到较多的b晶体,通常可采用 降温结晶的方法 |
| D.在t2℃时,要配制等质量的a、b的饱和溶液,需要相同质量的a、b |
某同学设计了下图所示的装置探究铁锈蚀的条件。a管中装入少量煮沸的蒸馏水,b管中是干燥的空气。调节L端与R端的液面高度一致,塞紧木塞。一周后观察。下列推断错误的是
| A.只有a管中的铁钉会锈蚀 |
| B.L端与R端的液面高度仍然保持一致 |
| C.植物油的使用可以减少水蒸发对实验的影响 |
| D.该实验可以说明铁的锈蚀与空气和水有关 |
下列是分析已变质氢氧化钠溶液的相关实验,其中合理的是
| 序号 |
实验目的 |
实验过程 |
| ① |
证明变质 |
取少量溶液,滴加盐酸,将生成的气体通入石灰水 |
| ② |
确定成分 |
取少量溶液,加入石灰水,过滤,向滤液中滴加酚酞溶液 |
| ③ |
测定纯度 |
取一定量溶液,加入盐酸,用氢氧化钠固体吸收气体,称量 |
| ④ |
除去杂质 |
取溶液,滴加石灰水至恰好完全反应,过滤 |
A.②③ B.①③ C.②④ D.①④
某混合气体可能是CO、CO2、H2、H2O、CH4之中的一种或几种组成,为了验证混合气体的成分,设计了如右图所示的装置进行实验(白色的无水硫酸铜遇水会变成蓝色,碱石灰是氢氧化钠和氧化钙的混合物),观察到的现象为:A中白色固体变蓝,B中澄清石灰水变浑浊,烧杯中有水雾,迅速取下烧杯,向其中倒入澄清石灰水,澄清石灰水变浑浊。则原混合气体的成分可能是
| A.CO、CO2 |
| B.H2O、H2 |
| C.CO2、H2O、CH4 |
| D.CO、CO2、H2O、H2 |
(6分)根据下列装置图,回答有关问题:
(1)写出实验室用大理石和稀盐酸制取二氧化碳的化学方程式:_________________,
并据此选择上图中____________(填字母)组装一套制取干燥二氧化碳的装置。
(2)如选用装置A作为制取氧气的发生装置,其化学方程式为____________________。
(3)写出实验室用锌和硫酸制取氢气的化学方程式:_________________。
(4)已知过氧化钠(Na2O2)固体和水在常温下反应能生成氧气和氢氧化钠,若用过氧化钠和水制氧气,可选用的发生装置是 ,此反应化学方程式为: 。
化学与生活密切相关,在厨房里蕴藏着许多化学知识。
(1)下列食物中,维生素含量比较丰富的是 (填字母序号);



| A.西红柿 | B.牛奶 | C.米饭 | D.鸡蛋 |
(2)酱油是重要的调味品,酱油适量加铁可以有效预防缺铁性贫血。铁是人体必须的_____(选填“常量”、“微量”)元素。
(3)为了有效防止菜刀生锈,可以采取的一种做法是________。
(5分)现有六种物质:①小苏打、②干冰、③熟石灰、④酒精、⑤合成橡胶、⑥石墨。请选择相应物质的序号填空:
(1)可用于改良酸性土壤的是___________;(2)实验室中常用的燃料是____________;
(3)可用于人工降雨的是_____________; (4)可用作抗酸药的是_______ __;
(5)可做汽车轮胎材料的是____________。
(1)下表列出了部分人体中含量较多元素的原子结构示意图。请据表回答下列问题:
| H |
O |
Na |
Mg |
Cl |
K |
Ca |
 |
|
|
|
|
|
|
①属于第二周期的元素是 。
②K+的核外电子数为 ;
③金属钠、钾的化学性质有许多相似之处,其原因是 。
④上表中的元素两两化合,能形成AB2型化合物的化学式为_____________(写一种)。
(2)在化学反应中,反应物分子间相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起化学反应。下图表示HI(碘化氢)分子之间的几种碰撞示意图,有些HI分子碰撞后,会发生化学反应产生H2和I2,有些碰撞不会发生反应。图中大球表示碘原子,小球表示氢原子。
①A、B、C三图中,表示HI分子碰撞后发生了化学反应的是 图(选填序号)。
②请写出上述所发生反应的化学方程式: ,
③若要得到1个H2分子,至少需要 个HI分子碰撞。
(6分)框图中的物质为初中化学所学的物质,其中A是白色固体,D是单质,B、F是固体氧化物;H可作补钙剂,E→C属于复分解反应。图中 “→”表示物质间存在转化关系;;部分反应条件、反应物或生成物已略去。
(1)写出化学式:A B
(2)F的俗名是: ,F→G反应能 (选填“放出”、“吸收”)热量。
(3)写出下列转化的化学方程式
①G→H: ;②E→C: 。
(6分)某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数。
(1)配制150g质量分数为8% 的氢氧化钠溶液。
①计算:需要氢氧化钠固体的质量为____________g,水的体积为__________mL(水的密度近似看作1g/cm3)。
②称量:调节托盘天平平衡后,将烧杯放在托盘天平的左盘,称量其质量。然后_____ (按操作的先后顺序选填字母),直至天平平衡。
A.将氢氧化钠固体加入烧杯中 B.按需要添加砝码、移动游码
③溶解:用量筒量取所需的水,倒入盛有氢氧化钠固体的烧杯里,搅拌,使其溶解,并冷却至室温。
④把配好的溶液装入试剂瓶,塞好橡皮塞并贴上标签。
(2)下图表示向20 g某稀盐酸中逐滴加入氢氧化钠溶液时PH的变化情况。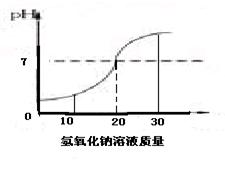
①根据曲线判断,当加入25 g氢氧化钠溶液时,所得溶液中的溶质为___________(写化学式)。
②该盐酸中溶质质量分数为 。
③反思:氢氧化钠具有较强的吸水性,若称取的氢氧化钠已部分吸水,则所求得的盐酸中溶质质量分数将 (填“偏大”“偏小”或“无影响”)。
金属是现代生活和工业生产中应用极为普遍的一类材料。
(1)图A是金属的一个应用实例,利用了金属的_______性。图B是两块金属片相互刻划后,在纯铜片上有明显的划痕。该实验探究的目的是_________________________。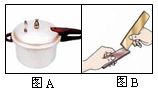
(2)已知在相同的条件下,金属的活动性越强,金属和酸反应产生气泡(氢气)的速度就越快。Al、Cu、Fe三种金属在稀盐酸里的反应现象如图所示。
①图中Y所代表的金属是 (填“Cu”或“Fe”);
②Al、Cu、Fe三种金属的活动性由强到弱的顺序为 ;
③铝是一种活泼金属,但常温下铝却有较强的抗腐蚀性,其原因是 ;
④将一片铝箔放到酒精灯火焰上加热,会发现熔化的铝并不滴落,好像有一层膜兜着。由此可知氧化铝的熔点 铝的熔点(填“>”或<”)。
(3)用一铝制易拉罐收集满一罐CO2气体,加入适量氢氧化钠溶液,封上口,振荡,会发现易拉罐先变瘪,过一段时间后又重新鼓起。
①拉罐变瘪的原因是(用化学方程式表示) 。
②易拉罐为什么又重新鼓起呢?原来铝是一种特殊的金属,能和氢氧化钠溶液反应生成偏铝酸钠(NaAlO2)和一种气体单质。已知:在一个化学反应中,如果有元素化合价的升高,必然有元素化合价的降低。则铝和氢氧化钠溶液反应生成的气体单质是
(4)下图是工业炼铁的基本生产流程示意图。请回答下列问题: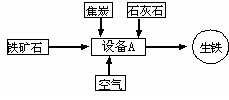
①写出设备A 的名称: ;
②写出以赤铁矿为原料在高温下制取铁的化学方程式: ;
③除了上面的炼铁方法之外,还可用铝热法炼铁,即用铝在高温下把氧化铁中铁置换出来,写出该反应的化学方程式 。
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
【产品与原理】
该厂采用“侯氏制碱法”生产化工产品——纯碱(Na2CO3)和化肥NH4Cl。
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应为:
NaCl(饱和)+ NH3 + CO2 + H2O = NaHCO3↓+ NH4Cl;分离出NaHCO3,加热制得纯碱。
【生产流程】
【相关资料】
⑴ NH4Cl NH3↑+HCl↑
NH3↑+HCl↑
⑵ 已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
| 物质 |
NaCl |
NaHCO3 |
NH4Cl |
NH3 |
CO2 |
| 溶解度 |
36.0g |
9.6g |
37.2g |
710 |
0.9 |
【问题讨论】:
⑴ 操作Ⅰ、Ⅱ的名称为 。
⑵ 反应①中发生了两个反应,写出其中的一个化学方程式:
。
⑶ 反应③中得到纯碱的化学方程式为: 。
⑷ 溶液B中的溶质有 (至少写出两种)。
⑸ 上述生产流程中可循环使用的是 (填序号)。
A.挥发性气体 B.溶液 C.氢氧化镁 D.化肥NH4Cl
【组成确定】
⑴ 称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
⑵ 另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。
由上述实验可确定纯碱样品含有杂质 (写化学式)。
【含量测定】
称取纯碱样品10.8g加入适量水,再加入过量CaCl2溶液,搅拌、过滤、洗涤、干燥后称得固体质量为10.0g,请通过计算并结合右表判断此纯碱样品等级为 品。计算过程:
【总结反思】
某同学认为,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小,其理由是 。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号