正确的操作是实验成功的保证。
(1)如图甲所示,实验室稀释浓硫酸时,①处的试剂是 (填字母序号),用玻璃棒不断搅拌的作用是 (填字母序号)。
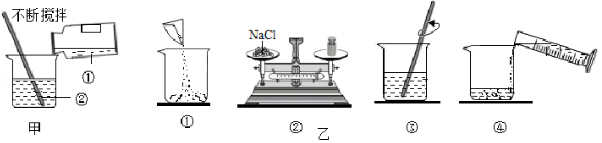
A.浓硫酸
B.水
C.引流
D.防止局部温度过高,造成酸液飞溅
(2)实验室配制一定溶质质量分数的氯化钠溶液的操作过程如图乙所示,正确的操作顺序是 (填字母序号)。
A.①②③④
B.②①④③
C.②①③④
粗盐提纯和溶液配制的实验中涉及以下实验操作,其中不正确的是( )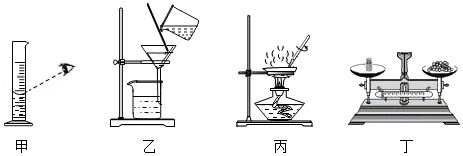
A.用图甲所示仪器量取液体
B.用图乙所示装置过滤悬浊液
C.用图丙所示装置蒸发溶液
D.用图丁所示仪器称量固体
实验室欲配制50克溶质质量分数为15%的氯化钠溶液,下列有关叙述正确的是( )
A.配制该溶液的步骤是称量和溶解
B.配制过程中用到的仪器只有天平、烧杯和玻璃棒
C.溶解氯化钠固体时,玻璃棒的作用是加快溶解速率
D.转移溶液时,用蒸馏水洗涤烧杯2~3次,将洗涤液一并倒入试剂瓶
配制50g质量分数5%的KNO3溶液,作为无土栽培所需的营养液,溶解过程中KNO3的质量分数随时间变化关系如图所示,观察图象,分析形成这种结果的原因是( )
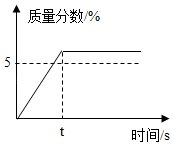
A.所用KNO3固体中含有水分
B.量筒量水时俯视刻度线
C.KNO3固体溶解前所用烧杯内有水
D.配好的溶液装瓶时部分液体洒落在试剂瓶外
科学兴趣小组的同学做粗盐(只含有难溶性杂质)提纯实验,并用所得的精盐配制50g 6%的氯化钠溶液。回答下列问题:
实验一:粗盐提纯
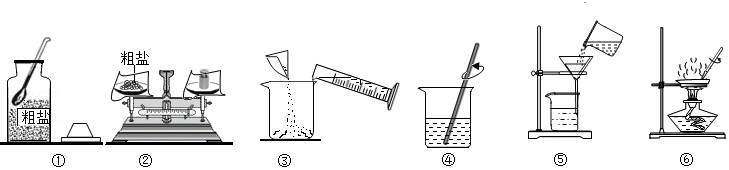
(1)如图中操作有错误的是 (填数字序号)。
(2)操作⑥中,当观察到蒸发皿中 时,停止加热。
(3)海水晒盐采用如图操作⑥的原理,不采用冷却氯化钠浓溶液的方法,原因是氯化钠的溶解度 。
实验二:用提纯得到的精盐配制50g 6%的氯化钠溶液
(1)计算。需要氯化钠 g,蒸馏水 mL。
(2)称量、量取。量取水的体积时,若仰视读数,所配溶液的溶质质量分数会 6%(填">""<"或"=")。
(3)溶解。用玻璃棒搅拌的目的是 。
(4)装瓶、贴标签。
某学生要配制一定溶质质量分数的NaOH溶液,实验操作如图所示,其中正确的是( )
A. 取用NaOH固体B.
取用NaOH固体B. 称量NaOH固体
称量NaOH固体
C.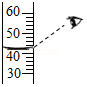 量取一定体积的水D.
量取一定体积的水D. 溶解NaOH固体
溶解NaOH固体
配制100g质量分数为15%的KNO3溶液,需要水 毫升(水的密度为1g/cm3)。在配制过程中量取水的体积时仰视读数,则所配制溶液的溶质质量分数 (选填“偏大”、“不变”、“偏小)。
以下是初中化学一些基本实验,请根据实验内容回答下列问题:
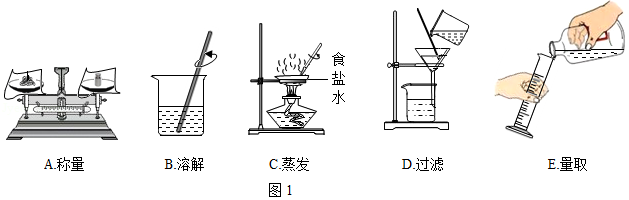
(1)利用如图1进行粗盐中难溶性杂质去除和配制一定质量分数氯化钠溶液的实验。
①粗盐中难溶性杂质去除的主要操作顺序是 (填字母序号);
②配制11%的氯化钠溶液100g。如按如图进行称量和量取,其它操作均规范无误,最终导致配制的氯化钠溶液的溶质质量分数 (填“大于”、小于”或“不能确定”)11%。
(2)如图为某小组探究金属化学性质的两组实验。
实验I |
实验Ⅱ |
|
|
①实验I中以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是 ;
②写出实验Ⅱ中C试管内反应的化学方程式 ;
③实验Ⅱ中要验证Cu、Fe、Ag的金属活动性顺序,至少要做的实验是 (填字母序号)。
防范新冠疫情,需要我们"戴口罩,勤洗手,勤消毒,勤通风"。
(1)医用口罩的核心材料是聚丙烯制成的熔喷布,聚丙烯属于 (填"金属材料"或"有机合成材料");
(2)请从微现角度解释:教室进行消杀后室内充满消毒液气味的原因 ;
(3)某消毒液稀释后pH=6,则稀释前其pH (填">"、"="或"<")6;
(4)在疫情期间要学会正确的洗手方法,沾有油污的手,可使用洗洁精清洗,洗洁精的作用是 ;
(5)"84消毒液"的主要成分是次氯酸钠(NaClO)。其中氯元素的化合价是 ,制取NaClO的原理是2NaOH+Cl 2═NaClO+X+H 2O,其中X的化学式是 ;
(6)某校要配制100kg溶质质量分数为0.2%的过氧乙酸消毒液,需要10%的过氧乙酸溶液 kg,所需水的质量为 kg。
2021年“世界水日”的主题为“珍惜水、爱护水”。
(1)2021年5月10日,“南水北调东线北延应急供水工程”启动向天津等地供水,以缓解我市可利用淡水资源 的现状。
(2)下列有关保护水资源的说法正确的是 (填序号)。
A.生活污水可直接排放
B.工业上对污染的水体作处理使之符合排放标准后再排放
C.农药、化肥的施用会造成水体污染,应该禁止施用
(3)如图是利用海水提取粗盐的过程。

根据海水晒盐的原理,下列说法正确的是 (填序号)。
A.进入贮水池中的海水,氯化钠的质量逐渐减少
B.在蒸发池中,海水中氯化钠的质量逐渐增加
C.析出晶体后,母液中的氯化钠溶液达到饱和
(4)某同学配制50g溶质质量分数为10%的氯化钠溶液。
①需要固体氯化钠的质量为 g。
②配制过程有以下步骤:a.称量及量取b.计算c.溶解d.装瓶贴标签,正确顺序是
(填序号)。
A.bcad
B.bacd
③将50g溶质质量分数为10%的氯化钠溶液,稀释成5%的氯化钠溶液,需要加水 g。
(5)为研究水的组成,某同学进行了电解水实验。
①电解水的化学方程式为 ;
②电解水的实验证明水是由 元素组成的。
氯化钠是生产、生活中的一种重要化合物,应用很广泛。
Ⅰ.图甲和图乙分别是钠原子和氯原子的原子结构示意图。

(1)图甲中的x= 。
(2)金属钠与氯气反应时,由图乙的结构可知,氯原子容易得到钠失去的1个电子,从而形成最外层有 个电子的相对稳定的氯离子,氯离子用化学符号表示为 。
Ⅱ.如表是氯化钠在不同温度下的溶解度数据。
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
37.8 |
(1)30℃时,将10g氯化钠加入到50g水中,充分搅拌后,所得到的氯化钠溶液属于
(填“饱和”或“不饱和”)溶液。
(2)医用盐水(溶质为NaCl)的溶质质量分数为0.9%,现有200mL该盐水(假定该溶液的密度为1g/mL),其中含NaCl的质量为 g。
(3)学生化学实验活动之一:配制50g质量分数为6%的氯化钠溶液,该实验需要的仪器有药匙、托盘天平、玻璃棒、胶头滴管、 (从下列图中选择写出名称)。

Ⅲ.工业上常用电解饱和食盐水的方法来制取氢氧化钠、氯气和氢气,其化学反应方程式可表示为:xNaCl+yH2O zNaOH+wH2+vCl2↑,若w=v=1,那么x=y=z=
zNaOH+wH2+vCl2↑,若w=v=1,那么x=y=z=
(填数字)。
某同学配制100g质量分数为11%的葡萄糖溶液,下列操作会导致所配溶液浓度偏高的是( )
A.用托盘天平称葡萄糖时,砝码放在左盘
B.转移葡萄糖时,纸上有少量残留
C.用量筒量取水时,俯视液面
D.配好溶液装入试剂瓶时,有少量洒出
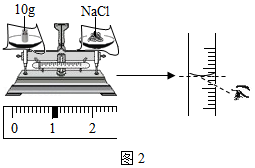
配制100g质量分数为16%的Na2CO3溶液,用于演示灭火器原理。回答下列问题。
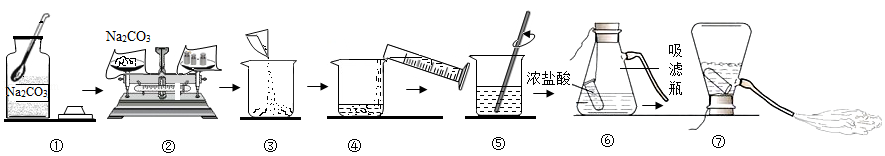
(1)计算Na2CO3的质量为 g,称量Na2CO3的仪器名称是 。
(2)20℃时,Na2CO3的溶解度为21.5g,⑤中的溶液 (填“是”或“不是”)该物质的饱和溶液。
(3)将烧杯中溶液倒入吸滤瓶的操作是 ,从橡胶管喷出大量液体的原因是 。
(4)酒精(C2H5OH)可作燃料,在空气中完全燃烧的化学方程式是 。酒精燃烧失火,可用干粉灭火器灭火。NaHCO3是干粉的主要成分,俗称是 。用干粉灭火器灭火的正确操作顺序是 → → (填序号)。
从如图选择仪器,配制60g溶质质量分数为10%的NaCl溶液。

(1)需要称量NaCl的质量为 g。
(2)量取水用到的仪器有 (写名称)。
(3)从配好的溶液中倒出10g,其中溶质和溶剂的质量比为 。