已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中Z与W左右相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同。请回答下列问题:
(1)Z的离子结构示意图是 ;
(2)X、Y、W可组成一化合物,其原子个数之比为4:1:1。其化学式中含有的化学键有 。
(3)YX3分子的空间构型是 ,Z的氢化物的稳定性比W的氢化物的稳定性_____(填“强”或“弱”)。
(4)Z2W2分子中,W与Z均满足8e-稳定结构,则Z 2W2的电子式为 。
肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体。
(1)肉桂酸甲酯由C、H、O三种元素组成,质谱分析其分子的相对分子质量为162,核磁共振氢谱谱图显示有6个峰,其面积之比为1:2:2:1:1:3,利用红外光谱仪检测其中的某些基团,测得红外光谱如下图:

则肉桂酸甲酯的结构简式是 (不考虑立体异构)
(2)已知:
I.醛与醛能发生反应,原理如下:

Ⅱ.已知烃A在标准状况下的密度为1.25g.L-1。合成肉桂酸甲酯的工业流程如下图所示:

请回答:
①化合物J的结构简式为 ;
②化合物G中的官能团有 ;
③G→H为 反应(填反应类型);
④写出反应D→E的化学方程式 ;
H→I的反应 (填“能”或“不能”)改用酸性高锰酸钾溶液,简述理由: 。
⑤符合下列条件的I的同分异构体共有5种。写出另两种同分异构体的结构简式:
A.能发生水解反应
B.与银氨溶液作用出现光亮的银镜
C.能与溴发生加成

今有①CH3COOH;②HCl;③H2SO4三种溶液,选择填空:
| A.①>②>③ | B.①<②<③ | C.①=②=③ | D.①=③>② |
E.①>②=③ F.①<②=③ G.①=②<③ H.①=②>③
(1)当它们pH相同时,其物质的量浓度关系是 。
(2)体积和物质的量浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为 。
(3)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为 。
(4)将pH相同的三种酸均稀释10倍后,pH关系为 。
(12分)如图装置闭合电键时,电流计A的指针将发生偏转。试回答下列问题。
(1)A池是____________;Zn的电极名称是____________;B池是____________;
Pt的电极名称是____________(填电解池、原电池、阴、阳、正、负极等)
(2)写出下列有关反应:C极上电极反应:_________________
(3)B池中的总反应的化学方程式为________________________
(8分)按要求写热化学方程式:
已知稀溶液中,1 mol H2SO4与NaOH溶液
恰好完全反应时,放出114.6 kJ热量,
写出表示H2SO4与NaOH反应的中和热的热化学方程式
_________________________________________________________________.
(2) 25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式______________________________________________________.
(3) 已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式_________________________________________.
(本题共8分)
烃A是一种重要的基本化工原料,用质谱法测得其相对分子质量为28。下图是以A为原料合成药物中间体E和树脂K的路线。

已知:I.
II.
(R、R’表示烃基或氢原子)
34.A中官能团的结构简式是 。有机物B的名称
35.B→C的化学方程式为 。B和氢氧化钠的水溶液加热反应所得到的有机产物和乙二酸反应生成高分子化合物,写出生成高分子化合物反应的化学方程式
36.E的分子式为C4H8O。下列关于E的说法正确的是 (填字母序号)。
a.能与金属钠反应 b.分子中4个碳原子一定共平面
c.一定条件下,能与浓氢溴酸反应 d.与CH2=CHCH2OCH2CH3互为同系物
37.G→H涉及到的反应类型有 。
38.I的分子式为C4H6O2,其结构简式为 。
39.J→K的化学方程式为 。
40.写出与E具有相同官能团的所有同分异构体的结构简式:
(不考虑顺反异构,不考虑—OH连在双键碳上的结构)。
下图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下的气态化合物,C为常温下的液态化合物,图中有部分生成物未标出。
请填写以下空白:

(1)A的化学式为 ,B的电子式为 。
(2)写出下列反应的化学方程式:
D+G→H 。
F+J→B+C+I 。
(3)0.3 mol I与足量C反应转移电子的物质的量为 mol。
(4)容积为10 mL的试管中充满I和G的混合气体,倒立于盛水的水槽中,水全部充满试管,则原混合气体中I与G的体积分别为 mL, mL。
有机物F(C9H10O2)是一种有茉莉花香味的酯。用下图所示的方法可以合成F。其中A是相对分子质量为28的烃,其产量常作为衡量石油化工发展水平的标志。E是只含碳、氢、氧的芳香族化合物,且苯环上只有一个侧链。
回答下列问题:
(1)A的分子式是____________;
(2)B的结构简式是________________________;
(3)为检验C中的官能团,可选用的试剂是____________;
(4)反应④的化学方程式是__________________。
(10分)环己烷可制备1,4-环己二醇,下列七步有关反应(其中无机产物都已经略去)中,试回答:

(1)写出下列化合物的结构简式:B: C:
(2)反应④所用的试剂和条件分别为:
(3)反应③的反应类型为
(4)写出④的化学方程式:④: 。
有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A与D按原子个数比1﹕1或2﹕l形成常温下为液态的化合物,E也能与D按原子个数比1﹕1或2﹕l形成化合物,B的外围电子数为内层电子数的两倍,B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物。请按要求回答以下问题:

(1)上图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示 ,E与D按原子个数比1﹕1形成的化合物的电子式为 。
(2)人们通常把拆开l mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
| 化学键 |
F—D |
F—F |
B—B |
F—B |
C═D |
D═D |
| 键能/kJ·mol-1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示):
a.F与B形成的化合物
b.B与D形成的稳定化合物
c.F的单质
②F单质晶体中一个F原子与其紧邻的F原子形成的空间构型为_____________,
③已知加热下可发生如下转化:
F(s) + D2(g) FD2(s)
FD2(s)
根据上表数据计算F单质晶体发生上述反应的反应热△H为: 。
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。
请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出A、B、C三种元素电负性由大到小的顺序 。
(2)由A、B、C和氢四种元素组成的某种离子晶体,1mol该晶体含有配位键2mol,该晶体的化学式是 。
(3)F和Mn(锰)两元素的部分电离能数据列于下表:预测a b(填“大于”、“小于”、“等于”),理由是
| 元素 |
Mn |
F |
|
| 电离能 (  ) ) |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
a |
b |
|
(4)AC2分子中σ键和π键数目比为 ;
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| |
熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
| H2S |
187 |
202 |
2.6 |
| H2C2 |
272 |
423 |
以任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因是:
熔点、沸点差异的主要原因
②在水中的溶解度差异的主要原因
工业上用乙烯和氯气为原料合成聚氯乙烯(PVC)。已知次氯酸能跟乙烯发生加成反应:CH2= CH2+HOCl→CH2(OH)CH2Cl。以乙烯为原料制取PVC等产品的转化关系如下图所示。

试回答下列问题:
(1)A中官能团的名称是 ,G的结构简式是 。
(2)写出D的同分异构体的结构简式: , 。
(3)写出反应⑥的化学方程式:______________________________________。
(4)写出C与D按物质的量之比为1∶2反应生成H的化学方程式 ____________。
(共14分)已知化合物A与B、丙与丁的组成元素分别相同,且四种物质中都含有同一种元素。A与B在常温下均呈液态。D与F都为固体单质,且D、 F与甲的浓溶液在常温下都会出现钝化现象,加热时有大量气体产生。(相关转化及部分反应条件和生成物未标出)。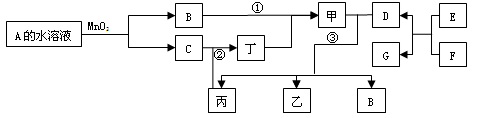
(1)A的结构式 , E与F的反应是 (填反应名称),写出2种该反应在工业生产中的用途: 、 。
(2)若反应①除生成甲外,还生成丙,写出过量D与甲的稀溶液反应的离子方程式:
(3)若A与丙可以化合生成甲;D与甲的浓溶液加热条件下可以生成三种化合物乙、丙、B,写出下列化学方程式②: ③:
甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系。
甲 + H2O → 丙 + 丁
(1)转化关系中所涉及的反应为非氧化还原反应。
①若甲是一种钠盐,丁为两性氢氧化物,则甲的化学式为 ,丁的酸式电离方程式为 。
②若甲是由N和Cl元素组成的化合物,其分子结构模型如图所示,丙具有漂白性。则甲中Cl元素的化合价是 ,丁与H2O有相同的电子总数,则丁的电子式为 
(2)转化关系中所涉及的反应为氧化还原反应。
①若甲和丙是同主族元素组成的单质,且组成甲的元素位于第三周期,此反应的离子方程式是 。
②若丙和丁都可在一定条件下还原CuO,此反应的化学方程式是 。
短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族;E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6。
(1)E在元素周期表中的位置是 。
(2)由A、C、F三种元素按原子个数比1∶1∶1组成的化合物与BA3反应生成B的单质, 写出该反应的化学方式 。
(3)常温下,若甲、乙两溶液的pH均等于5,则由水电离出的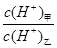 = ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
= ;乙溶液中所含离子的物质的量浓度由大到小的顺序是 。
(4)用图所示装置电解由D与F形成盐的饱和溶液时,若阴、阳极都用铁作电极,则阳极的电极反应式为 ,溶液中出现的现象是 。