有机物F(C9H10O2)是一种有茉莉花香味的酯。用下图所示的方法可以合成F。其中A是相对分子质量为28的烃,其产量常作为衡量石油化工发展水平的标志。E是只含碳、氢、氧的芳香族化合物,且苯环上只有一个侧链。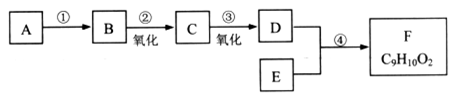
回答下列问题:
(1)A的分子式是____________;
(2)B的结构简式是________________________;
(3)为检验C中的官能团,可选用的试剂是____________;
(4)反应④的化学方程式是__________________。
有机物F(C9H10O2)是一种有茉莉花香味的酯。用下图所示的方法可以合成F。其中A是相对分子质量为28的烃,其产量常作为衡量石油化工发展水平的标志。E是只含碳、氢、氧的芳香族化合物,且苯环上只有一个侧链。
回答下列问题:
(1)A的分子式是____________;
(2)B的结构简式是________________________;
(3)为检验C中的官能团,可选用的试剂是____________;
(4)反应④的化学方程式是__________________。