某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42-。为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁。
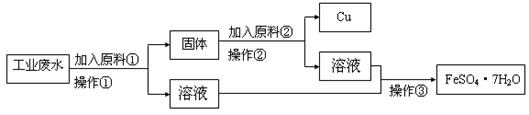
请回答:
(1)原料①为 。
(2)写出加入原料②后反应的离子方程式:____。
(3)该流程若在实验室中完成,操作②需要用到的玻璃仪器的名称是 ;操作③需要用到的下列实验装置是 (填字母)。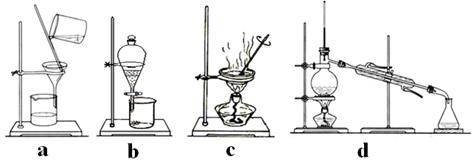
某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42-。为了减少污染并变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁。

请回答:
(1)原料①为 。
(2)写出加入原料②后反应的离子方程式:____。
(3)该流程若在实验室中完成,操作②需要用到的玻璃仪器的名称是 ;操作③需要用到的下列实验装置是 (填字母)。