有A、B、C、D、E、F六种元素,B原子得到一个电子后3P轨道全充满,A+比B形成的简单离子少一个电子层,C原子的P轨道半充满,它形成的氢化物的沸点是同主族元素的氢化物中最低的;D和E是位于同一主族的短周期元素,E元素的最高化合价与最低化合价的代数和为零,E在其最高价氧化物中的质量分数为46.67%;F元素的核电荷数比C元素大11。请回答:
(1)元素 X与C、B均相邻,比较C、X元素的第一电离能Il(C) I1(x)
(2)写出F元素原子的核外电子排布式 。
(3)位于C元素上周期同主族元素的氢化物沸点最高的原因是 ,其分子中心原子的杂化方式为 ,空间构型为 。
(4)D的最高氧化物是 分子(填“极性”或“非极性”),l mol这种氧化物分子中含有 molπ键,E的最高价氧化物的晶体类型是 。
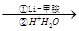 R—CHO;
R—CHO;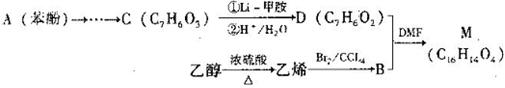
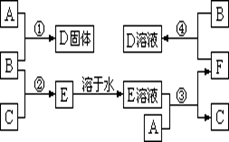
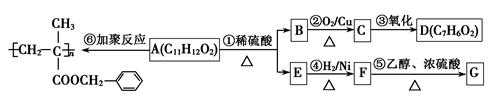




 粤公网安备 44130202000953号
粤公网安备 44130202000953号