高二化学第十五套(福建选修三)
下列涉及有机物的说法正确的是( )
| A.乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 |
| B.新制氢氧化铜悬浊液可以鉴别乙酸溶液、葡萄糖溶液、淀粉溶液 |
| C.煤的干馏、石油的分馏都只发生了化学变化 |
| D.棉、麻、丝、毛完全燃烧都只生成CO2和H2O |
下列表达式错误的是( )
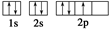
A.甲烷的电子式: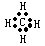 |
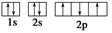
B.氮原子的L层电子轨道表示式: |
| C.硫离子的核外电子排布式:1s22s22p63s23p4 |
| D.碳原子最外层电子排布:2s22p2 |
元素周期表中铋元素的数据见下图,下列说法正确的是( )

| A.Bi元素的质量数是209 |
| B.Bi元素的相对原子质量是209.0 |
| C.Bi原子6p亚层有一个未成对电子 |
| D.Bi原子最外层有5个能量相同的电子 |
下列氢化物中稳定性由强到弱的顺序正确的是( )
| A.CH4>NH3>H2O>HF | B.SiH4>NH3>H2S>HCl |
| C.HF>H2O>NH3>PH3 | D.NH3>PH3>H2S>HBr |
电子从4P能级跃迁到3d能级时,可通过光谱仪直接摄取( )
| A.原子的发射光谱 | B.原子的吸收光谱 |
| C.电子的运动轨迹图像 | D.电子体积大小的图像 |
下面的排序不正确的是( )
| A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
| B.硬度由大到小:金刚石>碳化硅>晶体硅 |
| C.熔点由高到低:Na>Mg>Al |
| D.晶格能由大到小:NaF> NaCl> NaBr>NaI |
下列物质中能证明某化合物中一定有离子键的是( )
| A.晶体可溶于水 | B.具有较高的熔点 |
| C.水溶液可导电 | D.熔融状态能导电 |
在解释下列物质的性质变化规律与物质结构间的因果关系时,与键能无关的变化规律是( )
| A.与硅相比,金刚石的硬度大,熔点高 |
| B.HF、HCl、HBr、HI热稳定性依次减弱 |
| C.F2、Cl2、Br2、I2的沸点逐渐升高 |
| D.F2比O2更容易与H2反应 |
下列事实与氢键有关的是( )
| A.水加热到很高的温度都难以分解 |
| B.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增加而升高 |
| C.HF、HCI、HBr、HI的热稳定性依次减弱 |
| D.水结冰成体积膨胀,密度减少 |
若将15P原子的电子排布式写成1s22s22p63s23px23py1,它违背了( )
| A.能量守恒原理 | B.泡利不相容原理 |
| C.能量最低原理 | D.洪特规则 |
除去食盐溶液中的Ca2+、Mg2+、SO42-等杂质,需加入NaOH、Na2CO3、BaCl2和盐酸,加入顺序正确的是( )
| A.NaOH Na2CO3 BaCl2 HCl | B.Na2CO3 BaCl2 HCl NaOH |
| C.BaCl2 HCl NaOH Na2CO3 | D.NaOH BaCl2 Na2CO3 HCl |
合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。分析下表中的数据,不能形成合金的是( )
| |
Na |
Cu |
Al |
Fe |
| 熔点/℃ |
97.8 |
1083 |
660 |
1535 |
| 沸点/℃ |
883 |
2567 |
2467 |
2750 |
A.Cu和Al B.Fe和Cu C.Cu和Na D.Al和Na
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
| A.含氧酸的酸性:X对应的酸性强于Y对应的酸性 |
| B.第一电离能Y不一定小于X |
| C.X与Y形成化合物时,X显负价,Y显正价 |
| D.Y的气态氢化物的稳定性小于X气态氢化物的稳定性 |
“类推”是一种常用的学习方法,但有时会产生错误的结论,下列类推结论中正确的是( )
| A.IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物沸点顺序也是: AsH3>PH3>NH3 |
| B.第二周期元素氢化物的稳定性序是:HF>H2O>NH3, 则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3 |
| C.晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子 |
| D.干冰(CO2)是分子晶体,则SiO2也是分子晶体 |
四种短周期元素的性质或结构信息如下表。下列推断错误的是( )
| 元素编号 |
元素性质或结构 |
| T |
M层上有2对成对电子 |
| X |
元素最高正价是+7价 |
| Y |
第三周期元素的简单离子中半径最小 |
| Z |
单质是银白色固体、导电、密度比水小,与水剧烈反应、和氧气反应不同条件下产物不同 |
A.T的氢化物是同族元素氢化物中沸点最低的
B.X的最高价氧化物对应的水化物,是无机含氧酸中的最强酸
C.离子半径从小到大的顺序:Y<Z< T < X
D.X、Y形成化合物的晶体类型与X、Z形成化合物的晶体类型不同
(6分)现有下列物质, 用编号填空回答下列各问:
| A.干冰 |
| B.金刚石 |
| C.氩 |
| D.晶体硅 |
E.过氧化钠
F.二氧化硅
G.溴化铵
(1)通过非极性键形成的晶体是___________。
(2)固态时属于不含化学键的分子晶体是________。
(3)含有极性键的分子晶体是 。
(4)由极性共价键形成的晶体是_______ 。
(5)含有非极性键的离子化合物是 。
(6)含有离子键、共价键、配位键的化合物是 。
小刚同学探究二氧化硫分别与BaCl2溶液、Ba(OH)2溶液反应的实验。
(1)少量SO2通入到Ba(OH)2溶液中的离子反应方程式为 ,过量的SO2通入到Ba(OH)2溶液中的离子反应方程式为 。
(2)请回答有关问题。小刚同学将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:

则操作①的名称为 ,试剂A的化学式为 。
(3)实验表明,小刚加入试剂A后,白色沉淀未见溶解,则该白色沉淀的成分是______(填化学式),则产生该白色沉淀的离子方程式是__ _ ___。
碳、硅元素的单质及其化合物是构成自然界的重要物质。
(1)甲烷是最简单的有机物,实验室可通讨下列反应制取:
CH3COONa+NaOH CH4↑+X(已配平),X属于 晶体(填晶体类型)。
CH4↑+X(已配平),X属于 晶体(填晶体类型)。
(2)金刚石和石墨是两种重要的碳单质。
①以Ni—Cr—Fe为催化剂,一定条件下可将石墨转化为金刚石。基态Cr3+离子中未成对电子数有 个。
②石墨晶体能导电,导电的粒子是 。
(3)甲硅烷(SiH4)的结构与甲烷相似,甲硅烷能与硝酸银发生如下反应:
SiH4+8 AgNO3+2 H2O =" 8" Ag↓+SiO2↓+8 HNO3该反应中氢元素被氧化,由此可判断电负性:Si H(填“>”、“<”或“=”)
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。
请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出A、B、C三种元素电负性由大到小的顺序 。
(2)由A、B、C和氢四种元素组成的某种离子晶体,1mol该晶体含有配位键2mol,该晶体的化学式是 。
(3)F和Mn(锰)两元素的部分电离能数据列于下表:预测a b(填“大于”、“小于”、“等于”),理由是
| 元素 |
Mn |
F |
|
| 电离能 (  ) ) |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
a |
b |
|
(4)AC2分子中σ键和π键数目比为 ;
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| |
熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
| H2S |
187 |
202 |
2.6 |
| H2C2 |
272 |
423 |
以任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因是:
熔点、沸点差异的主要原因
②在水中的溶解度差异的主要原因
有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A与D按原子个数比1﹕1或2﹕l形成常温下为液态的化合物,E也能与D按原子个数比1﹕1或2﹕l形成化合物,B的外围电子数为内层电子数的两倍,B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物。请按要求回答以下问题:

(1)上图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示 ,E与D按原子个数比1﹕1形成的化合物的电子式为 。
(2)人们通常把拆开l mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
| 化学键 |
F—D |
F—F |
B—B |
F—B |
C═D |
D═D |
| 键能/kJ·mol-1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示):
a.F与B形成的化合物
b.B与D形成的稳定化合物
c.F的单质
②F单质晶体中一个F原子与其紧邻的F原子形成的空间构型为_____________,
③已知加热下可发生如下转化:
F(s) + D2(g) FD2(s)
FD2(s)
根据上表数据计算F单质晶体发生上述反应的反应热△H为: 。
(14分)下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是 (填编号)。写出⑩号元素的核外电子排布式_______________________________________;
④和⑤第一电离能的大小关系为________________(用元素符号表示)
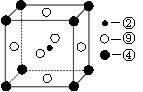
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为
(用对应的元素符号表示)。
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
| A.分子中含有氢键 |
| B.易发生加成反应 |
| C.含有4个σ键和1个π键 |
| D.分子中所有原子处于同一个平面 |
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的价电子数为 ; 该元素与元素①形成的分子X在①与③形成的分子Y中的溶解度很大,其主要原因是 。


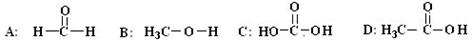



 粤公网安备 44130202000953号
粤公网安备 44130202000953号