用软锰矿(主要成分为MnO2)生产高锰酸钾产生的锰泥中,还含有18%的MnO2、3%的KOH(均为质量分数),及少量Cu、Pb的化合物等,用锰泥可回收制取MnCO3,过程如图:
(1)用软锰矿(主要成分为MnO2)生产高锰酸钾过程中,粉碎软锰矿的主要目的是______ 。
(2)锰泥中加入H2SO4、FeSO4混合溶液,反应的离子方程式是: __。
(3)经实验证明:MnO2稍过量时,起始H2SO4、FeSO4混合溶液中c(H+)/ <0.7时,滤液1中能够检验出有Fe
<0.7时,滤液1中能够检验出有Fe ;
; ≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①、②、③:
≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①、②、③:
①检验Fe2+是否氧化完全的实验操作是:__________________________ 。
②生 产时H2SO4、FeSO4混合溶液中c(H+)/c(Fe2+)控制在0.7~1之间,不宜过大,请结合后续操作从节约药品的角度分析,原因是:____ __。
③若c(H+)/c(Fe2+)>1,调节c(H+)/c(Fe2+)到0.7~1的最理想方法是:______(填序号)
a.NaOH溶液 b.铁粉 c.MnO
(4)写出滤液2中加入过量NH4HCO3反应的离子方程式:___ ____ 。
(5)上述过程锰回收率可达95%,若处理1740 kg的锰泥,可生产MnCO3__________kg(已知相对分子质量:MnO2 87;MnCO3 115)。
为测定碱式碳酸钴[COx(OH)y(CO3)z]的化学组成,研究性学习小组的同学设计了如图所示的装置进行实验探究。已知:碱式碳酸钴受热时可分解生成三种氧化物。
(1)按如图所示装置组装好仪器,并___________;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中_______(填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是__________。
(2)某同学认为上述实验中存在一个缺陷,该缺陷是_________。
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为__________。
(4)CoCl2·6H2O常用作多彩水泥的添加剂。以含钴废料(含少量Fe、Al等杂质)制取COCl2·6H2O的一种工艺如下:
已知:25℃时
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
CO(OH)2 |
Al(OH)3 |
| 开始沉淀(pH) |
2.3 |
7.5 |
7.6 |
3.4 |
| 完全沉淀(pH) |
4.1 |
9.7 |
9.2 |
5.2 |
①净化除杂时,加入H2O2发生反应的离子方程式为______________;
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为_________;
③加盐酸调整pH为2~3的目的为___________;
④操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤。
草酸亚铁和草酸铁常用作照相显影剂或制药工业。I.某化学兴趣小组的同学进行草酸亚铁晶体(FeC2O4·2H2O)分解产物的实验探究。他们设计了如下装置进行实验(夹持装置未画出),干燥管B、G中装有无水氯化钙,试管D、F、I中盛有澄清石灰水。
(1)烧瓶A中盛有饱和NH4C1和饱和NaNO2的混合液,常用于实验室制N2,则该反应的化学方程式为_____________________________。
(2)实验时先打开活塞a,并加热烧瓶A一段时间,其目的是___________________。
(3)①试管D中出现浑浊,证明分解产物中有____________存在。
②证明分解产物中存在CO的现象是______________________________。
③要证明分解时产生的另一种气态产物的存在,应该如何改进装置______________。
④将C中充分反心后的固体残余物投入经煮沸的稀硫酸中,固体完全溶解且无气体放出,取反应液加入KSCN溶液无血红色,证明固体产物为_____________(填化学式)。
II.三氯化铁是合成草酸铁的重要原料。已知草酸铁晶体在低温时溶解度较小。
(4)利用工业FeCl3(含杂质)制取纯净的草酸铁晶体【Fe2(C2O4)3·5H2O】的实验流程如下图所示:
①溶液X为浓盐酸,目的是_________________。
②上述流程中FeCl3可用异内醚萃取,其原因是__________________。
③所得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是___________________。
④为测定所得草酸铁晶体的纯度,实验室中用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于__________(填“酸式”或“碱式”)滴定管中。
软锰矿的主要成分为MnO2,工业可用其按如下方法制备高锰酸钾:
a.将软锰矿初选后粉碎,与固体苛性钾混合,加入反应釜中敞口加热至熔融,并保持熔融状态下搅拌25~30 min,冷却得墨绿色熔渣(主要成分为K2MnO4);
b.将熔渣粉碎,加入去离子水溶解,充分搅拌后过滤得墨绿色滤液1;
c.取适量70%硫酸,加入滤液1中,边加边搅拌,直至不再产生棕褐色沉淀,过滤,得紫色滤液2;
d.提纯滤液2即可得高锰酸钾粗品。
根据上述内容回答下列问题:
(1)步骤a中,反应物熔融状态下搅拌的目的是: ,用化学方程式表示出MnO2转化为K2MnO4的反应原理: 。
(2)粉碎后的软锰矿与苛性钾置于 中进行加热。
A.陶瓷反应釜 B.石英反应釜 C.铁制反应釜
(3)写出步骤c中反应的离子方程式: 。
(4)步骤d中由滤液2得到高锰酸钾粗品的主要操作步骤是: 。
(5)若将母液循环使用,可能造成的问题是: 。
(6)早先有文献报道:步骤a中加入KClO3固体会缩短流程时间以及提高高锰酸钾的产率,但从绿色化学角度考虑后,现在工厂中一般不采用此法,你认为这种方法不符合绿色化学的原因是: 。
过渡金属的单质及化合物很多有催化性能,氯化铜、氯化亚铜经常用作有机合成催化剂。实验室中用氯气与粗铜(杂质只有Fe)反应,制备铜的氯化物的流程如下。
查阅资料:
氯化亚铜:白色微溶于水,在干燥空气中稳定,受潮则易变蓝棕色,在热水中迅速水解生成氧化铜水合物而呈红色。
氯化铜:从水溶液中结晶时,在15℃以下得到四水物,在15~25.7℃得到三水物,在26~42℃得到二水物,在42℃以上得到一水物,在100℃得到无水物。
(1)现用如图所示的实验仪器及药品制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。
①按气流方向连接各仪器接口顺序是:a→ 、 → h 、i → 、 → 。
②本套装置有两个仪器需要加热,加热的顺序为先 后 ,这样做的目的是 。
(2)分析流程:
①固体甲需要加稀盐酸溶解,其理由是 ;
②溶液甲可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号) 。
a.NaOH b.NH3·H2O c.CuO d.CuSO4
③完成溶液乙到纯净CuCl2·2H2O晶体的系列操作步骤为:
加少量盐酸、蒸发浓缩、 、 、洗涤、干燥。
(3)向溶液乙中加入适当的还原剂(如SO2、N2H4、SnCl2等),并微热得到CuCl沉淀,写出向乙溶液加入N2H4(氧化产物为无毒气体)的离子方程式: 。此反应只能微热的原因是 。
(4)若开始取100g 含铜96%的粗铜与足量Cl2反应,经上述流程只制备CuCl2·2H2O,最终得到干燥产品277g,求制备CuCl2·2H2O的产率 ;(精确到1%)分析出现此情况的主要原因 。
硫酸亚铁铵又称莫尔盐,是浅绿色晶体。它在空气中比一般亚铁盐稳定,是常用的Fe2+试剂。某实验小组利用工业废铁屑制取莫尔盐,并测定其组成,他们进行了以下实验。
Ⅰ.莫尔盐的制取

(把图中“一定实验步骤”换成“加热蒸发、浓缩结晶”)
请回答下列问题。
(1)废铁屑中含氧化铁,无需在制备前除去,理由是__________________(用离子方程式回答),实验前都需将废铁屑放入碳酸钠溶液中煮沸,倾倒出液体,用水洗净铁屑。从以下仪器中选择组装,完成该操作必需的仪器有________(填编号)。
①铁架台 ②玻璃棒 ③广口瓶 ④石棉网 ⑤烧杯 ⑥漏斗 ⑦酒精灯
(2)步骤2中加热方式 (填“直接加热”﹑“水浴加热”或“沙浴”);必须在铁屑少量剩余时,进行热过滤,其原因是 。
II.莫尔盐组成的测定
①将摩尔盐低温烘干后,称取7.84 g加热至100℃失去结晶水,质量变为5.68 g。
②选择下图所示的部分装置连接起来,检查气密性后,将上述5.68g固体放入A装置的锥形瓶中,再向锥形瓶中加入足量NaOH浓溶液,充分吸收产生的气体并测出气体质量为0.68 g。
③向A中加入适量3%的H 2 O 2溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后,测得其质量为1.6 g。

根据上述实验回答下列问题。
(3)步骤②中,选择的装置是A接_______接_______(填代号),A装置中未使用分液漏斗的理由是______________。
(4)向锥形瓶中加入NaOH溶液的操作方法是_______;吸收A中产生的气体所用试剂应是_______。实验小组的同学为保证A中产生的气体被完全吸收以准确测量其质量,他们在A中反应停止后再进行的操作是______________。
(5)根据上述实验数据计算,摩尔盐中 =_______。
=_______。
(14分)丁酸异戊酯又称香蕉油,多用于食品和化妆品的香精,实验室用正丁酸与异戊醇反应制备丁酸异戊酯,有关数据和装置示意图如下:
实验步骤:
①如图连接好装置,在三颈烧瓶中加入0.2 mol异戊醇和0.1 mol正丁酸、数滴浓硫酸、5 ML苯和2-3片碎瓷片。充分摇匀,分水器内加入异戊醇直至与支管相平;
②在122-.132℃下回流反应1.5 h即可得粗产品;
③冷却后用10%的NaOH溶液中和,用水洗至中性,加入无水硫酸镁后蒸馏得较纯净的丁酸异戊酷11 g.
回答下列问题:
(1)图中A仪器的名称是 ,冷却水应从 (选择a或b)口进。
(2)在该实验中,三颈烧瓶的容积最适合的是 (填入正确选项前的字母)。
A.50 mL B.100 ML C.200 mL
(3)加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是 (填入正确选项前的字母)。
A.冷却后补加 B.立即补加 C.不需补加 D.重新配料
(4)加入过量异戊醇的目的是 ,分离提纯过程中加入无水硫酸镁的目的是 。
(5)在蒸馏得较纯净的丁酸异戊酯操作中,仪器选择及安装都正确的是 (填标号)。
(6)本实验的产率是 。(保留三位有效数字)
有关铝的几个实验如下。请填写下列空白。
实验一 毛刷实验
实验过程如下图。
(1)配制Hg(NO3)2溶液时,为抑制水解,需加入少量的_____。
(2)铝导线放NaOH溶液的目的是除去表面的氧化膜,其化学方程式为_____。
(3)生成白色毛状物的实质是铝发生电化腐蚀生成A12O3,其中作正极材料的是______ (填序号)。
a.O2 b.A1 c.Hg(NO3)2 d.Hg
实验二 探究白色毛状物是否含有结晶水
取适量白色毛状物样品放入仪器X称量,质量为m1 g
(4)仪器X应选用以下哪个装置____________________(填名称)。
(5)上述过程中“冷却"时要在图1所示的装置中进行的原因是______________________.
(6)根据所得实验资料,能说明白色毛状物含结晶水的证据是_________(用代数式表示)。
实验三 验证A12O3对石蜡油裂解的催化作用
按图2连好装置,检查装置的气密性,加入5~6 g Al2O3,加热到500℃左右,往Al2O3上滴入石蜡油。已知:石蜡油为液态烷烃混合物(与汽油类似),沸点164~223 ℃。
一定条件下,其裂解产物为乙烯和烷烃的混合物。
(7)使用装置B的目的是___________________。
(8)需要再补充一个实验才能证明Al2O3对石蜡油裂解反应有催化作用,请简述其实验方案:__________。
(15分)某工厂回收电镀污泥[主要成分为Cu(OH)2、Ni(OH)2、Fe(OH)2、Al(OH)3和砂土]中的铜和镍,工艺流程如下:
(1)下列措施中,可提高步骤①浸出速率的是___________。
a.加热
b.增大压强
c.延长浸出时间
d.适当提高硫酸的浓度
e.及时分离出产物
(2)步骤②电解过程中铜粉在_______(填“阴"或“阳”)极产生。若始终没有观察到气体生成,则该电解过程的离子方程式为_______。
(3)已知FePO4、.A1PO4、Ni3(PO4)2的Kap分别为1.0 x l0-22、1.0 x l0-19、4.0 x 10-31,步骤 ②所得溶液中c(Ni2+)为O.1 mo1·L-1。步骤③反应后溶液中c(PO43-)理论上应控制的范围是_____ mo1·L-1 (离子浓度小于1O-5 mo1·L-1可视为沉淀完全)。
(4)步骤④的萃取原理为[注:(HA)2为有机萃取剂]
NiSO4(水层)+2(HA)2(有机层)  Ni(HA2)2(有机层)+H2SO4(水层)
Ni(HA2)2(有机层)+H2SO4(水层)
为促使上述平衡向正反应方向移动,可采取的具体措施是_____(写一条即可)。
(5)步骤⑤中作为反萃取剂的最佳试剂为_____(填名称)。
(6)该工艺流程中,可以循环使用的物质有______。
(15分)节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染。实验小组同学欲测定空气中SO2的含量,并探究SO2的性质。
I.某实验小组同学拟用下图所示简易装置测定空气中SO2的含量。
实验操作如下:按图连接好仪器,检查装置气密性后,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+ H2O2=H2S04)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.233mg。
(1)计算所测空气中SO2含量为_______mg·L-1。
(2)已知常温下BaS03的Ksp为5.48x10-7,饱和亚硫酸溶液中c(S032-)=6.3x10-8{mol·L-1。
有同学认为以上实验不必用H2O2吸收SO2,直接用O.1mol·L-1BaCl2溶液来吸收S02即可产生沉淀。请用以上数据分析这样做是否可行________________.
U.另一实验小组同学依据SO2具有还原性,推测SO2能被C12氧化生成SO2C12。
用如图所示装置收集满C12,再通入SO2,集气瓶中立即产生无色液体,充分反应后,将液体和剩余气体分离,进行如下研究。
(3)写出二氧化锰和浓盐酸反应制取氯气的离子方程式____________________.
(4)研究反应的产物。向所得液体中加水,出现白雾,振荡、静置得到无色溶液。经检验该溶液中的阴离子(除OH-外)只有S042-、C1-,证明无色液体是SO2C12。
写出SO2C12与H2O反应的化学方程式_______________________________________.
(5)研究反应进行的程度。用NaOH溶液吸收分离出的气体,用盐酸酸化后,再滴加BaCl2溶液。产生白色沉淀。
①该白色沉淀的成分是_____________.
②SO2和C12生成SO2C12的反应________可逆反应(填“是”或“不是”),阐述理由___________.
镍行业发展蕴藏着巨大的潜力。某小组用废镍催化剂(成分为 等)制备草酸镍晶体(NiC2O4·2H2O)的部分实验流程如下:
等)制备草酸镍晶体(NiC2O4·2H2O)的部分实验流程如下:
(1)“粉碎”的目的是______________________________________________.
(2)实验过程中多次进行过滤。过滤操作中,除需用到玻璃棒、烧杯外,还需用到的玻璃仪器有_______.
(3)保持其他条件相同。在不同温度下对废镍催化剂进行”酸浸”。镍浸出率随时间变化如图。以下四个选项中最适宜的条件是____________(填字母)。
a.30℃、30min b.90℃、150min
c.70℃、120min d.90℃、120min
(4)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是______________________________.
(5)草酸镍晶体(NiC2O4·2H2O)在热空气中干燥;脱水后,再隔绝空气高温煅烧3小时,制得三氧化二镍,同时获得一种混合气体。写出草酸镍(NiC2O4。)高温分解的化学方程式________________.
(6)工业上还可用电解法制取三氧化二镍。电解过程中产生的CIO-把二价镍氧化为三价镍。
写出C10-氧化Ni(OH)2生成三氧化二镍的离子方程式__________________________________.
(7)用1000g废镍催化剂(镍含量为a%),理论上可制备草酸镍晶体的质量为________g(只列式不计算。已知:NiC2O4·2H2O的相对分子质量为183)。
实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
| 药品 |
相对分子质量 |
熔点/℃ |
沸点/℃ |
溶解性 |
密度(g•cm-3) |
| 甲醇 |
32 |
-98 |
-64.5 |
与水混溶,易溶于有机溶剂 |
0.79 |
| 甲基丙烯酸 |
86 |
15 |
161 |
溶于热水,易溶于有机剂 |
1.01 |
| 甲基丙烯酸甲酯 |
100 |
-48 |
100 |
微溶于水,易溶于有机溶剂 |
0.944 |
实验步骤:
向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;按图示连接装置加热烧瓶中混合液,通过分水器分离出水,用锥形瓶盛接收集产生的水;当不再有水生成,停止加热;冷却后用试剂X洗涤烧瓶中的混合溶液并分离;取有机层混合液减压蒸馏,得到较纯净的甲基丙烯酸甲酯。请回答下列问题:
(1)A装置的名称是______________________。
(2)上述实验中浓硫酸有提高甲基丙烯酸甲酯产率的作用,其原理____________________.但是浓硫酸过多,产率降低,原因是________________________.
(3)上述实验可能生成的副产物结构简式为_______________(填一种即可)
(4)试剂X宜选择_________________.
a.饱和食盐水 b.氢氧化钠溶液 c.饱和碳酸钠溶液
(5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为_______。实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是__________.
a.分水器收集的水里含甲酯 b.实验条件下发生副反应
c.产品精制时收集部分低沸点物质 d.产品在洗涤、蒸发过程中有损失
(12分)氢溴酸在医药和石化工业上有广泛用途.图1是模拟工业制备氢溴酸的流程:
回答下列问题:
(1)混合①中发生反应的离子方程式为 .
(2)混合②中加入试剂a是 .
(3)加入Na2SO3的目的是除去过量的Br2,但要防止过量,原因是 (请用离子方程式表示).
(4)工业氢溴酸常带有淡淡的黄色,可能的原因是:①含Fe3+②含Br2③含Fe3+和Br2,只用下列一种试剂就能分析产生淡黄色的原因.该试剂是 (填写字母).
a.KMnO4溶液
b.NaOH溶液
c.KSCN溶液
d.淀粉KI溶液
e.CCl4
(5)实验室制取Br2的反应为:2NaBr+3H2SO4+MnO2 2NaHSO4+MnSO4+Br2↑+2H2O制取Br2最好选用图2装置中的 (填写字母,固定和加热装置均已省略).简述检验已选定的图2装置气密性的方法 .
2NaHSO4+MnSO4+Br2↑+2H2O制取Br2最好选用图2装置中的 (填写字母,固定和加热装置均已省略).简述检验已选定的图2装置气密性的方法 .
(15分)亚硝酸钠大量用于染料和有机合成工业。用木屑制备亚硝酸钠的流程如下:
已知氧化过程中,控制反应液的温度在55~60℃条件下发生的主要反应为:
C6H12O6+12HNO3 3H2C2O4+9NO2↑+3NO↑+9H2O
3H2C2O4+9NO2↑+3NO↑+9H2O
(1)酸溶过程中,硫酸的作用是_________。吸收完成后,将吸收液蒸发浓缩、________、________(填操作名称)、洗涤得到白色晶状的亚硝酸钠。
(2)实验室模拟氧化和吸收过程的装置如图所示,A装置须控制反应液的温度不高于60℃的原因是____;B装置用于制备亚硝酸钠,其中盛放的溶液是________(填字母)。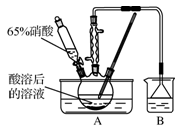
a.NaCl溶液 b.Na2CO3溶液 c.NaNO3溶液
(3)工业上在吸收过程中需控制NO和NO2的物质的量比接近1∶1。若(NO)∶n(NO2)>1∶1,则会导致________;若n(NO)∶n(NO2)<1∶1会使产品中混有的杂质为________。
(4)已知NaNO2能把酸性条件下的Fe2+氧化,同时产生一种有毒的气体,请写出该反应的离子方程式:________________________________。
(5)已知:①NaNO2有氧化性,在酸性条件下能把I-氧化为I2;S2O32-又能把I2还原为I-。②NaNO2也有还原性,能使酸性KMnO4溶液褪色。
为测定产品NaNO2的纯度,请补充完整实验方案:准确称量适量的NaNO2样品放入锥形瓶中,加适量水溶解,________。
实验中可供选择的试剂:稀硫酸、c1 mol·L-1 KI溶液、淀粉溶液、c2 mol·L-1 Na2S2O3溶液、c3 mol·L-1酸性KMnO4溶液。
从某废触媒[主要成分为活性炭、ZnO、FeO、(CH3COO)2Zn]中制取醋酸锌晶体的实验步骤如下:
(1)浸取时,在三口烧瓶中加入废触媒及稀醋酸,给三口烧瓶加热并同时开动搅拌器的目的是 。
(2)若先将废触媒在马弗炉中通氧气500℃处理一段时间,浸出率会大大提高,其原因是 。抽滤时用的硅酸盐质仪器有 和 。
(3)流程图中加入H2O2的目的是 。
(4)所得晶体(CH3COO)2Zn·2H2O热重分析(TG/%=固体样品的剩余质量/固体样品的起始质量),文献表明分解分三个阶段,在200°C以下脱去两分子结晶水,形成的(CH3COO)2Zn在242°C熔融,370°C完全分解为ZnO同时生成CO2及一种含氧衍生物(核磁共振氢谱只有1组峰)。(CH3COO)2Zn分解生成氧化锌的反应方程式为 。