草酸亚铁和草酸铁常用作照相显影剂或制药工业。I.某化学兴趣小组的同学进行草酸亚铁晶体(FeC2O4·2H2O)分解产物的实验探究。他们设计了如下装置进行实验(夹持装置未画出),干燥管B、G中装有无水氯化钙,试管D、F、I中盛有澄清石灰水。
(1)烧瓶A中盛有饱和NH4C1和饱和NaNO2的混合液,常用于实验室制N2,则该反应的化学方程式为_____________________________。
(2)实验时先打开活塞a,并加热烧瓶A一段时间,其目的是___________________。
(3)①试管D中出现浑浊,证明分解产物中有____________存在。
②证明分解产物中存在CO的现象是______________________________。
③要证明分解时产生的另一种气态产物的存在,应该如何改进装置______________。
④将C中充分反心后的固体残余物投入经煮沸的稀硫酸中,固体完全溶解且无气体放出,取反应液加入KSCN溶液无血红色,证明固体产物为_____________(填化学式)。
II.三氯化铁是合成草酸铁的重要原料。已知草酸铁晶体在低温时溶解度较小。
(4)利用工业FeCl3(含杂质)制取纯净的草酸铁晶体【Fe2(C2O4)3·5H2O】的实验流程如下图所示: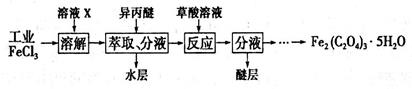
①溶液X为浓盐酸,目的是_________________。
②上述流程中FeCl3可用异内醚萃取,其原因是__________________。
③所得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是___________________。
④为测定所得草酸铁晶体的纯度,实验室中用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于__________(填“酸式”或“碱式”)滴定管中。


 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
 粤公网安备 44130202000953号
粤公网安备 44130202000953号