(10分)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等。可以电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图:
请回答下列问题:
(1)用稀硫酸溶解废渣时,为了提高浸取速率可采取的措施有____________(任写一点)。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式:_________________。
(3)上述流程中滤液Ⅲ的主要成分是____________。
(4)确定步骤四中Na2CO3溶液足量,碳酸镍已完全沉淀的简单实验方法是___________。
(5)操作Ⅰ的实验步骤依次为(实验中可选用的试剂:6mol·L-1的H2SO4溶液、蒸馏水、pH试纸):
①_________________________;
②_________________________;
③蒸发浓缩、冷却结晶,过滤得NiSO4·6H2O晶体;
④用少量乙醇洗涤NiSO4·6H2O晶体并晾干。
某烧碱溶液中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
| A.在250ml的容量瓶中定容成250ml烧碱溶液; |
| B.用碱式滴定管取25ml烧碱溶液于锥形瓶中并滴加几滴甲基橙指示剂; |
| C.在天平上准确称取烧碱样品Wg,在烧杯中加蒸馏水溶解; |
| D.将物质的量浓度为Mmol/L的标准硫酸溶液装入酸式滴定管,调整液面,记下开始刻读数为V1ml |
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻读数为V2 ml
回答下列问题:
①正确的操作步骤的顺序是 → → →D → .
②操作E中在锥形瓶下垫一张白纸的作用 。
③操作D中液面应调整到 ,尖嘴部分应 。
④滴定终点时瓶内溶液的PH约为 ,终点时颜色变化是 。
⑤若酸式滴定管没有用标准硫酸溶液润洗,会对测定结果有何影响? (填偏高、偏低、无影响,其他操作均正确)
⑥该烧碱样品的纯度计算式为 。
实验室配制500mL0.2mol/LNa2SO4溶液,实验操作步骤如下:
| A.用托盘天平上移出14.2g硫酸钠固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并冷却至室温. |
| B.把制得的溶液小心地转移到容量瓶中. |
| C.继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切. |
| D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡. |
E.将容量瓶瓶塞塞紧,充分摇匀.
回答下列问题:
(1)操作步骤的正确顺序为(填序号)______________________;
(2)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是_______。
(3)下列情况会使所配溶液浓度偏高的是(填序号)___________。
a.某同学观察液面的情况如图所示
b.没进行上述的操作步骤D
c.加蒸馏水时,不慎超过了刻度线
d.砝码上沾有杂质
e.容量瓶使用前内壁沾有水珠
氮的氧化物( )是大气污染物之一,工业上在一定温度和催化剂条件下用 将 还原生 成 , 某同学在实验室中对 与 反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的_ , 反应的化学方程式为_ 。
②预收集一瓶干燥的氨气,选择上图中的装置, 其连接顺序为: 发生装置→ (按气流方向, 用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的 充入注射器 中, 硬质玻璃管 中加入少量催化剂, 充入 (两端用夹 子 夹好)。在一定温度下按图示装置进行实验。

| 操作步骤 |
实验现象 |
解释原因 |
| 打开 , 推动注射器活塞, 使 X中的气体缓慢通入 Y 管中 |
(1)Y 管中 |
(2反应的化学方程式 |
| 将注射器活塞退回原处并固 定, 待装置恢复到室温 |
Y 管中有少量水珠 |
生成的气态水凝集 |
| 打开 |
|
|
如下图所示,a、b均为活塞,可控制气体的通过和液体的加入,实验前活塞均已关闭(仪器的固定装置已省略)。请选择最适宜的试剂,利用下图,把一定量的CO2和CO混合气体中的CO2和CO分离。可供选择的试剂有:浓硫酸、稀硫酸、浓盐酸、稀盐酸、澄清的石灰水、氢氧化钠溶液、紫色石蕊试液。
(1)甲装置的烧瓶中盛放的试剂是_____________,分液漏斗中盛放的试剂是__________;
(2)乙装置的瓶中盛放的试剂是_______________。
(3)打开活塞a时,分离出来的气体是__________________;要得到另一种气体时,正确的操作是__________________________。
现有下列化学仪器与用品:①玻璃棒 ②烧杯 ③托盘天平 ④量筒 ⑤药匙 ⑥胶头滴管 ⑦容量瓶 ⑧标签纸 ⑨细口试剂瓶
(1)称量:若需要配制460mL 0.1moL/L NaOH溶液,则应称取固体NaOH g;
(2)用以上称量后的NaOH固体配制溶液并备用:按配制溶液的过程顺序,从上述所给仪器和用品中选取需要的仪器(重复的不计),其编号排列是 ;
(3)配制过程中,应将固体NaOH溶解后并冷却至室温的溶液转移到 中;在液面接近容量瓶刻度线 处,改用 定容。
(4)若实验中遇到下列情况,可能导致溶液浓度偏高的是 (填字母):
| A.固体氢氧化钠溶解时未冷却至室温,就开始转移、洗涤以及定容; |
| B.转移时不小心有少量溶液流到了容量瓶外; |
| C.定容时仰视容量瓶刻度线; |
| D.定容时加水超过了刻度线,马上用胶头滴管吸去多余的水。 |
E、配制好后,发现称量时所用的托盘天平的砝码生锈了
如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关反应的化学方程式为___________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是________(填编号)。
| 编号 |
a |
b |
c |
d |
| Ⅰ |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| Ⅱ |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| Ⅲ |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
装置B是安全瓶,监测实验进行时C中是否发生堵塞,写出发生堵塞时B中的现象___________。
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是___________________________。
该现象________(填“能”或“不能”)说明Br2的氧化性强于I2。
(4)有人提出,装置F中可改用过量的NaHSO3溶液吸收余氯,试写出相应反应的离子方程式_________________;你认为___________(填“能”或“不能”)改用NaHSO3溶液。
实验室模拟“镁法工业烟气脱硫”并制备 ,其实验过程可表示为
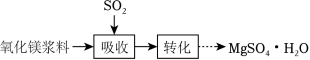
(1)在搅拌下向氧化镁浆料中匀速缓慢通入 气体,生成 ,反应为 ,其平衡常数 与 的代数关系式为 __________;下列实验操作一定能提高氧化镁浆料吸收 效率的有_____(填序号)。
| A. |
水浴加热氧化镁浆料 |
| B. |
加快搅拌速率 |
| C. |
降低通入 气体的速率 |
| D. |
通过多孔球泡向氧化镁浆料中通 |
(2)在催化剂作用下 被 氧化为 。已知 的溶解度为 , 氧化溶液中 的离子方程式为__________;在其他条件相同时,以负载钴的分子筛为催化剂,浆料中 被 氧化的速率随 的变化如题图甲所示。在 范围内,pH增大,浆料中 的氧化速率增大,其主要原因是__________。
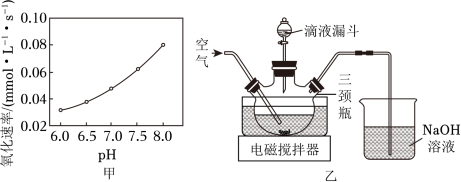
(3)制取 晶体。在如题图乙所示的实验装置中,搅拌下,使一定量的 浆料与 溶液充分反应。 浆料与 溶液的加料方式是__________;补充完整制取 晶体的实验方案:向含有少量 的 溶液中,_______________。(已知: 在 时完全转化为氢氧化物沉淀;室温下从 饱和溶液中结晶出 , 在 下干燥得到 ,实验中需要使用 粉末)
超纯 是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯 方面取得了显著成果,工业上以粗镓为原料,制备超纯 的工艺流程如图:

知:①金属 的化学性质和 相似, 的熔点为 ;
② (乙醚)和 (三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
|
物质 |
|
|
|
|
|
沸点/ |
|
|
|
|
回答下列问题:
(1)晶体 的晶体类型是_____;
(2)“电解精炼”装置如图所示,电解池温度控制在 的原因是__________,阴极的电极反应式为_____;

(3)“合成 ”工序中的产物还包括 和 ,写出该反应的化学方程式_______________;
(4)“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是_____;
(5)下列说法错误的是_____;
A.流程中 得到了循环利用
B.流程中,“合成 ”至“工序 ”需在无水无氧的条件下进行
C.“工序 ”的作用是解配 ,并蒸出
D.用核磁共振氢谱不能区分 和
(6)直接分解 不能制备超纯 ,而本流程采用“配体交换”工艺制备超纯 的理由是 ____________________;
(7)比较分子中的 键角大小: _____ (填“>”“<”或“=”),其原因是__________。
钴配合物[Co(NH3)6]Cl3溶于热水,在冷水中微溶,可通过如下反应制备:2CoCl2+2NH4Cl+10NH3+H2O2 2[Co(NH3)6]Cl3+2H2O
2[Co(NH3)6]Cl3+2H2O
具体步骤如下:
Ⅰ.称取2.0gNH4Cl,用5mL水溶解。
Ⅱ.分批加入3.0gCoCl2•6H2O后,将溶液温度降至10℃以下,加入1g活性炭、7mL浓氨水,搅拌下逐滴加入10mL6%的双氧水。
Ⅲ.加热至55~60℃反应20min。冷却,过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的25mL沸水中,趁热过滤。
Ⅴ.滤液转入烧杯,加入4mL浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
(1)步骤Ⅰ中使用的部分仪器如图。

仪器a的名称是 。加快NH4Cl溶解的操作有 。
(2)步骤Ⅱ中,将温度降至10℃以下以避免 、 ;可选用 降低溶液温度。
(3)指出下列过滤操作中不规范之处: 。

(4)步骤Ⅳ中,趁热过滤,除掉的不溶物主要为 。
(5)步骤Ⅴ中加入浓盐酸的目的是 。
近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为: 。下图为刚性容器中,进料浓度比 c(HCl) ∶ 分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
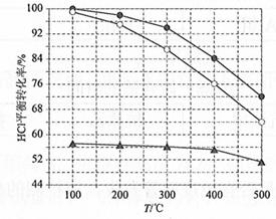
可知反应平衡常数 K(300℃)________ K(400℃)(填"大于"或"小于")。设HCl初始浓度为 , 根据进料浓度比 c(HCl)∶ c(O 2)=1∶1的数据计算 K(400℃)=________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比 c(HCl)∶ 过低、过高的不利影响分别是________。
(2)Deacon直接氧化法可按下列催化过程进行:
Δ
Δ
Δ
则 的 Δ H=________ 。
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是________。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
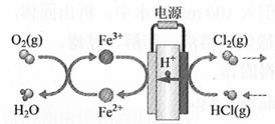
负极区发生的反应有________(写反应方程式)。电路中转移1 mol电子,需消耗氧气________L(标准状况)
凯氏定氨法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量.已知: .
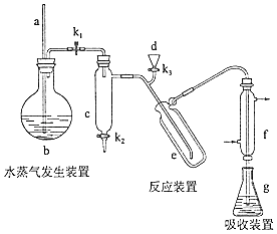
回答下列问题:
(1)a的作用是________.
(2)b中放入少量碎瓷片的目的是________.f的名称是________.
(3)清洗仪器:g中加蒸馏水:打开 , 关闭 、 , 加热b,蒸气充满管路:停止加热,关闭 , g中蒸馏水倒吸进入c,原因是________;打开 放掉水,重复操作2~3次.
(4)仪器清洗后,g中加入硼酸( )和指示剂,铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭 , d中保留少量水,打开 , 加热b,使水蒸气进入e.
①d中保留少量水的目的是________.
②e中主要反应的离子方程式为________,e采用中空双层玻璃瓶的作用是________.
(5)取某甘氨酸( )样品m 克进行测定,滴定g中吸收液时消耗浓度为 的盐酸 ,则样品中氮的质量分数为________%,样品的纯度≤________%.
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置:
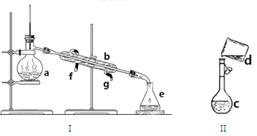
(1)写出下列仪器的名称:A. B. C.___________
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是 ,将仪器补充完整后进行实验,温度计水银球的位置在 处。冷凝水的进出方向为 。
(3)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是 。除了图中给出的的仪器和托盘天平外,为完成实验还需的仪器有: 。
②根据计算得知,所需NaOH的质量为 g
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示.
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是(填装置序号)______________.
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为_____________,____________;与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)______________.
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体应是(填化学式)____________.
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。当碳酸氢钠与氢氧化钙物质的量之比为2:1时,所得溶液中溶质的化学式为_____________,请设计实验检验所得溶液中溶质的阴离子______________.
实验题

I.(1)写出上图中A仪器的名称___________(2)冷凝管的进水口为_____________(填字母)
Ⅱ.实验室要配制2 mol/L稀硫酸240 mL。
(1)量取浓硫酸时,用下面那种规格的量筒____________(填序号)
①10 ml ②50 ml ③100 ml ④500 ml
(2)配制该稀硫酸时使用的仪器除量筒、烧杯外,还必须用到的仪器有 、 、 等.
(3)在配制过程中,如果出现下列情况,将对所配溶液的物质的量浓度有何影响?(填“偏高”、“偏低”或“无影响”)
①用量筒量取浓硫酸时,仰视量筒进行读数_____________;
②定容时,液面超过刻度线后用胶头滴管吸至液面处_____________;
③ 容量瓶事先有水,没干燥_____________
III.200ml 5mol/lNaOH溶液中含溶质的质量是 g,取出20 ml溶液,其溶质的物质的量浓度是 。将取出的溶液稀释至100 ml,其溶质的物质的量浓度是 。