江苏省泰州市姜堰区高一上学期期中测试化学试卷
下列包装标识贴错了的是
| 选项 |
A |
B |
C |
D |
| 物质 |
浓硫酸 |
汽油 |
小苏打 |
硝酸钾 |
| 标识 |
 |
 |
 |
 |
下列仪器:①烧杯 ②锥形瓶 ③圆底烧瓶 ④试管 ⑤坩埚,其中可用酒精灯直接加热的仪器是
| A.①②③④ | B.④⑤ | C.①③ | D.④ |
分类是化学学习和研究的常用方法之一。下列物质的分类正确的是
| A.生石灰是氧化物 | B.甲烷属于电解质 | C.纯碱属于碱 | D.铝是常用氧化剂 |
下列溶液中,Na+的物质的量浓度最大的是
| A.5 mL 0.6 mol/L Na2SO4溶液 | B.10mL 0.3 mol/LNa3PO4溶液 |
| C.5 mL 0.4 mol/LNaOH溶液 | D.10mL 0.5 mol/L NaNO3溶液 |
下列关于胶体的叙述错误的是
| A.胶体区别于其它分散系的本质特征是分散质的微粒直径在1nm~100nm之间 |
| B.用平行光照射CuSO4溶液和Fe(OH)3胶体,可以加以区分 |
| C.把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体 |
| D.胶体是一种介稳性的分散系,其粒子能通过滤纸 |
氧化还原反应在生产、生活中具有广泛的用途,下列事实中不涉及氧化还原反应的是
| A.铁质菜刀生锈 | B.燃放烟花爆竹 |
| C.食物腐败变质 | D.煅烧石灰石 |
下列物质在水溶液中的电离方程式书写正确的是
| A.H2SO4 === H++ SO42- | B.Ba(OH)2=== Ba2+ +(OH—)2 |
| C.KClO3 === K+ + 3O2— + Cl5+ | D.Al2(SO4)3===2Al3+ + 3SO42— |
下列化学实验操作或事故处理方法正确的是
| A.如果没有试管夹,可以临时手持试管给固体或液体加热 |
| B.酒精灯不慎碰倒起火时,可用湿抹布或沙子盖灭扑灭,不能用水泼灭 |
| C.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
| D.少量浓硫酸沾到皮肤上时,可立即用大量水冲洗,然后涂上20%~30%的NaOH溶液 |
四种基本反应类型与氧化还原反应的关系如下图所示,则下列化学反应中属于区域3的反应是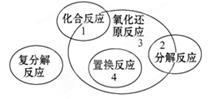
| A.Zn + H2SO4 = ZnSO4 + H2↑ |
B.H2 + Cl2 2HCl 2HCl |
C.2KClO3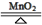 2KCl+3O2↑ 2KCl+3O2↑ |
| D.2Cl2+2Ca (OH)2 = CaCl2+Ca(ClO)2+2H2O |
在强碱性的无色溶液中能大量共存的离子组是
| A.K+、Mg2+、MnO4—、C1— | B.Na+、Ba2+、NO3—、C1— |
| C.Na+、Fe3+、SO42—、C1— | D.NH4+、K+、HCO3—、NO3— |
下列中和反应的离子程式能以H++OH-===H2O表示的是
| A.醋酸和氢氧化钠溶液 | B.氢氧化镁和硝酸 |
| C.氢氧化钠溶液和稀硫酸 | D.氢氧化钡和稀硫酸 |
设NA表示的值,下列叙述正确的是
| A.标准状况下,2. 24LCH4含有的H原子数为0.1NA |
| B.常温常压下,NA个CO2分子占有的体积为22.4L |
| C.1 mol·L-1 A1Cl3溶液中含有的Cl-数目为3NA |
| D.2.4g金属镁变为镁离子时失去的电子数为0.2 NA |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向溶液X中先加盐酸酸化,无现象,再加入AgNO3溶液 |
白色沉淀 |
X中一定含Cl— |
| B |
向溶液Y中先加盐酸酸化,无现象,再加入BaCl2溶液 |
白色沉淀 |
Y中一定含SO42- |
| C |
溶液Z中加入碳酸钠溶液产生白色沉淀,再加盐酸 |
白色沉淀 消失 |
Z中一定含Ba2+ |
| D |
钠盐W溶液中,加入稀盐酸,并将产生的气体通入澄清石灰水 |
石灰水 变浑浊 |
W一定是Na2CO3 |
已知反应:2FeCl3+2KI===2FeCl2+I2+2KCl,H2S+I2===S+2HI,2FeCl2+Cl2===2FeCl3,由此得出下列微粒氧化性由强到弱的顺序为
| A.Cl2 > I2> Fe3+ > S | B.Cl2 > Fe3+ > I2 > S |
| C.Fe3+ > Cl2 > I2 > S | D.S > I2 > Fe3+ > Cl2 |
a g KNO3溶于b g水,形成V mL饱和溶液。下列关系式错误的是
A.KNO3物质的量浓度:c(KNO3)= mol·L-1 mol·L-1 |
B.20 ℃时KNO3的溶解度S= g g |
C.KNO3质量分数:w(KNO3)= % % |
D.该溶液的密度ρ= g·L-1 g·L-1 |
除去括号内的杂质,写出除杂的试剂,并写出溶液中反应的离子方程式。
(1)FeSO4(CuSO4)试剂 ,离子方程式__________________。
(2)CO2 (HCl) 试剂 ,离子方程式____________________。
(3)Cu(CuO)试剂 ,离子方程式_______________________。
(1)下列物质中:①饱和食盐水 ②CaCO3 ③酒精 ④NH3 ⑤Al ⑥KOH ⑦液态HCl
能导电的有 ,属于电解质的有 (填编号)。
(2)在标准状况下,下列四种气体量的关系从大到小的排列顺序是(用序号表示)
a.6.72L O2 b.3.01×1023个HCl c.13.6g H2S d.0.2molNH3
①四种气体在相同条件下的密度 。
②四种气体的原子个数 。
(3)将10 mL质量分数为48%的H2SO4溶液,用水稀释至100 mL,所得H2SO4溶液的质量分数________4.8%(选填“>”、“<”或“=”)。
某离子反应的反应物和产物如下:MnO4— + I—+ H+→ Mn2++ I2 + IO3—+ H2O
(1)该反应中被还原的元素是 ,氧化产物是 。
(2)如果该反应方程式中I2的化学计量数是3、IO3—的化学计量数是4,请配平上述反应并用单线桥法标出电子转移的方向和数目。
MnO4—+ I—+ H+ === Mn2+ + 3I2 + 4IO3—+ H2O
如下图所示,a、b均为活塞,可控制气体的通过和液体的加入,实验前活塞均已关闭(仪器的固定装置已省略)。请选择最适宜的试剂,利用下图,把一定量的CO2和CO混合气体中的CO2和CO分离。可供选择的试剂有:浓硫酸、稀硫酸、浓盐酸、稀盐酸、澄清的石灰水、氢氧化钠溶液、紫色石蕊试液。
(1)甲装置的烧瓶中盛放的试剂是_____________,分液漏斗中盛放的试剂是__________;
(2)乙装置的瓶中盛放的试剂是_______________。
(3)打开活塞a时,分离出来的气体是__________________;要得到另一种气体时,正确的操作是__________________________。
实验室用NaOH固体配制500mL 1.2mol/L的NaOH溶液,请回答下列问题:
(1)需用托盘天平称取NaOH的质量 g。
(2)容量瓶上需标有以下五项中的 。
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(用字母表示)___________ __。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需NaOH的质量于烧杯中,加入少量水(约100mL),用玻璃棒慢慢搅拌,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与容量瓶刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
G.检查容量瓶是否漏水
(4)下列操作会使所配制的溶液浓度偏低的是 (填字母)。
A.用称量纸称量NaOH固体
B.配制前容量瓶中有少量蒸馏水
C.溶液注入容量瓶前未冷却到室温
D.加蒸馏水定容时不慎超过了刻度线
E.定容时俯视刻度线
 MnCl2+Cl2↑+2H2O。现将17.4gMnO2与200g 36.5%的浓盐酸(过量)完全反应,把反应后所得溶液稀释到400ml。计算:
MnCl2+Cl2↑+2H2O。现将17.4gMnO2与200g 36.5%的浓盐酸(过量)完全反应,把反应后所得溶液稀释到400ml。计算: 粤公网安备 44130202000953号
粤公网安备 44130202000953号