某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究 元素性质递变规律。
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液,酚酞溶液等。仪器:① ,② ,③ ,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式)
| 实验步骤 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 实验现象(填A~F) |
|
|
|
|
|
|
① ,② 。
(4)实验结论: 。
某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂从下列固物质中
a. NH4HCO3、b. NH4Cl、c. Ca(OH)2、d. NaOH。
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是________(填备选试剂的字母);此时A中主要的玻璃 仪器有________________(填名称)。
仪器有________________(填名称)。
(2)A中产生的物质被B中Na2O2充分吸收,写出任意一个B中发生反应的化学方程式:_____________________。
(3)对于C中发生的可逆反应,下列说法正确的是________。
a. 增大一种反应物的浓度可以提高另一种反应物的转化率
b. 工业上进行该反应时,可采取高压的条件提高反应物转化率
c. 该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4∶5
(4)请在下图坐标中画出C装置中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式。
(5)待实验结束后,将B中固体混合物溶于500mL1mol·L-1盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是____mol,甲在标准状况下是_____L(忽略气体的溶解)。
把10mL淀粉胶体和5mL KCl溶液的混合液体加入用半透膜制成的袋中,将此袋浸入蒸馏水中。2min后用两支试管各取5mL烧杯中的液体,并做如下实验:
(1)向其中一支试管中滴加少量AgNO3溶液,其现象是
;
(2)向另一支试管里滴加少量碘水,其现象是
;
(3)由上述现象可以得出的结论是
。
把相同物质的量浓度的盐酸、NaOH、NaCl、CH3COOH、NH3·H2O、C2H5OH溶液分别倒入六个烧杯中,接通电源。试回答:
(1)为什么连接C2H5OH的水溶液的灯泡不亮;其余的灯泡均亮了;
(2)为什么连接盐酸、NaOH、NaCl的水溶液的灯泡亮度一致,连接CH3COOH、NH3·H2O的水溶液的灯泡亮度一致且比连接HCl、NaOH、NaCl的水溶液的灯泡要暗。
如图所示,在一烧杯中盛有H2SO4溶液, 同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入与H2SO4溶液同浓度的Ba(OH)2溶液至恰好完全反应。试回答下列问题:
同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入与H2SO4溶液同浓度的Ba(OH)2溶液至恰好完全反应。试回答下列问题:
 (1)该实验中,观察到的现象有
(1)该实验中,观察到的现象有
① ,
② 。
(2)写出该实验中反应的离子方程式
。
某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol· L-1盐酸、0.55mol· L-1NaOH溶液,尚缺少的实验玻璃用品是 、 。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?
(填“能”或“否”),其原因是 。
(3)他们记录的实验数据如下:
| 实验用品 |
溶液温度 |
中和热 △H |
|||
| t1 |
t2 |
||||
| ① |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.3℃ |
|
| ② |
50mL0.55mol.L-1NaOH |
50mL.0.5mol.L-1HCl |
20℃ |
23.5℃ |
已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各物质的密度均为1g·cm-3。
根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:
(4)若用KOH代替NaOH,对测定结果 (填“有”或“无”)影响。
请用下图的装置设计一个实验,以测定SO2转化为SO3的转化率。
(1)这些装置的连接顺序(按气体从左到右的方向)是______________。(填各接口的编号)
(2)实验时甲仪器的作用与原理是______________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是______________。
(4)Ⅳ处观察到的现象是______________。
(5)在Ⅰ处用大火加热烧瓶时SO2的转化率会______________。(填“填大”“不变”或“减小”)
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重 m g,则本实验中SO2的转化率为______________。
(14分)化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,图中所列装置是用燃烧法确定有机物分子式常用的装置。
完成下列问题:
(1)产生的氧气按从左到右流向,所选择的装置各导管的连接顺序是________________。
(2)C装置中浓硫酸的作用是__________________。
(3)D装置中MnO2的作用是__________________。
(4)燃烧管中CuO的作用是__________________。
(5)若准确称取0.09 g样品(只含C、H、O三种元素中的两种或三种)经充分燃烧后,A管质量增加13.2 g,B管质量增加0.54 g,则该有机物的实验式为__________________________。
(6)要确定该有机物的分子式,还要_______________。
(1)可以验证镁、铝的金属性强弱的实验是___________。
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
(2)现有MgCl2溶液、AlCl3溶液、NaOH溶液、氨水、盐酸等几种物质,试设计实验方案证明镁、铝的金属性强弱。
(8分)粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验完成下列问题。
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程①放置酒精灯;②固定铁圈位置;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌;⑤停止加热。其正确的操作顺序为___________。
(2)在粗盐经过溶解、过滤后的溶液中滴加稍过量BaCl2溶液,目的是除去___________。
(3)再滴加饱和Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的是_________________________。最后加适量盐酸将多余的Na2CO3除去。
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中
都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:玻璃棒用来搅拌,加速溶解。
过滤时:______________________________________________________________________。
蒸发时:______________________________________________________________________。
试样X由FeO和CuO组成。取质量相等的两份试样按如下所示流程图进行实验:
(1)请写出步骤③中所发生的全部反应的离子方程式。
(2)若全部的溶液Y和全部的粉末Z充分反应后,生成的不溶物W的质量是m,每份试样X中氧化铜的质量为__________(用m表示)。
硫酸亚铁是一种可用于治疗缺铁性贫血的药剂,硫酸亚铁药片外表包有一层特制的糖衣,以保护硫酸亚铁不被空气中的O2氧化成硫酸铁。请设计一种方法,验证某硫酸亚铁药品是否已被氧化。请写出主要步骤、现象及化学方程式。
实验室中用右图装置制取氯气:
试完成下列问题:
(1)该反应是氧化还原反应吗?___________,如果是氧化还原反应,请指出___________是氧化剂,___________是还原剂,写出该反应的离子方程式______________________________。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大),其作用是______________________________________________。
(3)氯气溶于水显酸性,且氯气有毒,并有强烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用____________________溶液来吸收有毒的氯气。
实验室制取SO2的反应原理为:Na2SO3+H2SO4(较浓)====Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率。
(1)这些装置的连接顺序(按气体左右的方向)是_________→_________→_________→
_________→_________→_________→_________→(填各接口的编号)。
(2)实验时甲仪器的作用与原理是
_________________________________________________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是____________。
(4)Ⅳ处观察到的现象是_____________________________________________。
(5)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为___________。
某校研究性学习小组选择使用下列仪器和药品,验证由铜和适量浓硝酸反应产生的气体中含有NO(实验中使用的N2和O2的用量可自由控制)。已知:①NO+NO2+2OH-====2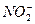 +H2O;②气体液化温度:NO2:21 ℃、NO:-152 ℃
+H2O;②气体液化温度:NO2:21 ℃、NO:-152 ℃
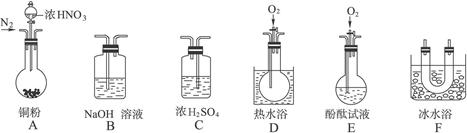
(1)现有甲、乙、丙三位同学分别设计了以下三个实验方案(用仪器的连接顺序表示)。
甲:A→C→F→D→B 乙:A→B→C→E 丙:A→F→D→B
甲、乙、丙三位同学提出的实验方案是否能验证Cu与适量浓HNO3反应产生的气体中含有NO(填“能”或“不能”):
甲:_______________;乙:_______________;丙:_______________。
具体说明不能验证的主要原因(能验证的方案,不必回答原因):
甲方案:______________________________________________________________________。
乙方案:______________________________________________________________________。
丙方案:______________________________________________________________________。
(2)实验开始时首先通入足量的N2,其目的是____________________________________。
(3)确认气体中含NO的现象是_________________________________________________。
(4)如果O2过量,则装置B中发生反应的离子方程式是______________________________。