反应A+3B=2C+2D在4种不同情况下的反应速率分别为:
该反应进行快慢的顺序为____________________.
(1)1.2g碳与适量水蒸气反应生成CO和H2,需吸收13. 128kJ热量,此反应的热化学方程式为_________________________________________。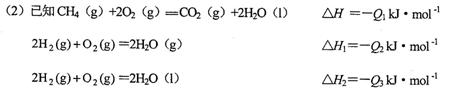
常温下,取体积比4:1的甲烷和氢气的混合气体11.2 L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为____________。
已知X是一种具有果香味的合成香料,下图为合成X的某种流程:
提示:① 不能最终被氧化为—COOH;
不能最终被氧化为—COOH;
②D的产量可以用来衡量一个国家的石油化工水平。
请根据以上信息,回答下列问题:
(1)A分子中官能团的名称是__________,X的结构简式是________。
(2)上述A、B、C、D、E、X六种物质中,互为同系物的是________________。
海水制取溴:
(1)主要流程:
(2)主要反应(化学反应方程式):
_____________________________________。
(3)最后分离实验操作是 、
根据所给信息填空
已知:①A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
回答下列问题:
(1)A、B、C、D中所有原子都在同一平面上的是________。
(2)写出下列反应的反应类型:①________,④________。
(3) B、D的结构简式 ,
如图是某种只含有C、H、O、N的有机物简易球棍模型。请回答下列各题。
(1)该分子属氨基酸,其分子式为________。
(2)在一定条件下,该分子可以通过聚合反应生成________(填“糖类”“油脂”或“蛋白质”)。
(3)在一定条件下,该分子可以与乙醇发生反应,请写出该反应的化学方程式_________。
冶炼金属常用以下几种方法:
A.以C、CO或H2做还原剂; B.热分解法;
C.利用铝热反应原理还原; D.电解法。
下列金属各采用哪种方法还原最佳。(用序号填写下列空白。)
(1)Fe、Zn、Cu等金属 ;(2)Na、Mg、Al等金属 ______ ;
(3)Hg、Ag等金属 ;(4)V、Cr、Mn、W等高熔点金属 。
在铝热反应 Fe2O3 + 2 Al  2 Fe + Al2O3中,作为氧化剂的物质是__ (填化学式),作为还原剂的物质是 (填化学式);
2 Fe + Al2O3中,作为氧化剂的物质是__ (填化学式),作为还原剂的物质是 (填化学式);
铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是 ________(用字母代号填)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是 ________nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_________________________________________________________。
某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是_________________________,在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为43.05 g.溶液中c(Cl-)= mol/L.
(4)若要验证该溶液中含有Fe2+,正确的实验方法是 。
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+。
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+。
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:
A请写出上述实验中加入或生成的有关物质的化学式:
①_____________②____________③______________④________________
B请写出通入⑥的化学方程式__________________________________
化学计量在化学中占有重要地位,请回答下列问题:
(1)0.3 mol NH3分子中所含原子数与 个H2O分子中所含原子数相等。
(2)含0.4 mol A13+的Al2(SO4)3中所含的SO 的物质的量是 _____ 。
的物质的量是 _____ 。
(3)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为 ____________ 。
(4)在一定的温度和压强下,1体积气体X2跟3体积气体Y2化合生成2体积化合物,则该化合物的化学式是______________。
(5)某盐混合溶液中含有离子:Na+、Mg2+、Cl-、SO42-,测得Na+、Mg2+和Cl-的物质的量浓度依次为: 0.2 mol·L-1、0.25 mol·L-1、0.4 mol·L-1,则 c(SO42-)="___________" 。
有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验: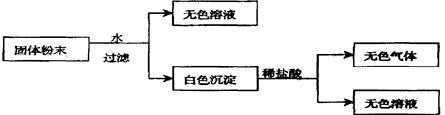
从实验可以判断,该固体粉末中(1)一定不含有 ,
(2)它的组成可能是 或 。
(3)加入盐酸后发生反应的离子方程式为 。
(4)要进一步确定其组成还应进行的实验操作是 。
化学实验中,如果使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如: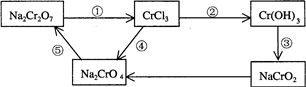
(1)在上述有编号的步骤中,需用还原剂的是 ,需用氧化剂的是 。(填编号)
(2)在 K2Cr2O7 + 14HCl ="===" 2KCl + 2CrCl3 + 3Cl2↑+ 7H2O反应中, 元素被氧化,
="===" 2KCl + 2CrCl3 + 3Cl2↑+ 7H2O反应中, 元素被氧化,
是氧化剂;并用双线桥表明电子转移方向与数目: 。
(3)在(2)的反应中,盐酸的作用: 。
已知以下两个氧化还原反应的化学方程式:
①Cl2+H2O===HCl+HClO ②2Al+Fe2O3 Al2O3+2Fe
Al2O3+2Fe
(1)用单线桥法表示反应②中的电子转移情况:______。
(2)若反应②中每生成1 mol Fe,转移电子的物质的量是:________。
(3)将反应①改写成离子方程式:________。