海水制取溴:
(1)主要流程: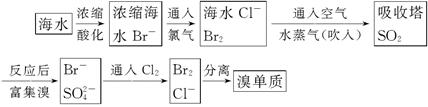
(2)主要反应(化学反应方程式):
_____________________________________。
(3)最后分离实验操作是 、
海水制取溴:
(1)主要流程:
(2)主要反应(化学反应方程式):
_____________________________________。
(3)最后分离实验操作是 、