某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:

(1)该反应的化学方程式: ;
(2)反应开始至2min末,X的反应速率为 ;
(3)平衡时Z的转化率为 .
(4)3min后图中曲线所表示的含义是 .
有人设计出一种在隔绝空气条件下让钠与FeSO4溶液反应的方法以验证反应实质。实验时,往100 mL大试管中先加40 mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入用煮过的蒸馏水配制的FeSO4溶液使煤油的液面至胶塞,并夹紧弹簧夹(如图)。仔细观察,回答下列问题:
(1)有关钠反应的现象是__________________________。
(2)大试管的溶液中出现的现象:____________________________。
(3)装置中液面的变化:大试管内___________;长颈漏斗内____________。
(4)写出钠与硫酸亚铁溶液反应的化学方程式:____________________。
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列问题:
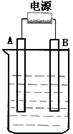
(1)A接的是电源的 极,B是该装置 极,B电极反应式为 。
(2)写出电解时反应的总离子方程式 。
(3)电解后溶液的pH为 ;要使电解后溶液恢复到电解前的状态,则需加入 ,其质量为 。(假设电解前后溶液的体积不变)
(4)MnO2可作超级电容器材料。用惰性电极电解酸性MnSO4溶液可制得MnO2,其阳极的电极反应式是____________________
下列共有四组物质,请按要求回答下列问题
| |
X |
Y |
Z |
| ① |
NaOH溶液 |
Al(OH)3 |
稀硫酸 |
| ② |
MgCl2溶液 |
酚酞溶液 |
NaCl溶液 |
| ③ |
Na2O |
Na2CO3 |
NaHCO3 |
| ④ |
KOH溶液 |
Al |
稀盐酸 |
(1)同组物质中,X、Y、Z均是属于电解质的是 (填数字符号)。
(2)同组物质中,Y既能与X发生氧化还原反应,又能与Z发生氧化反应反应的是 (填数字符号)。
(3)写出第①组X与Y反应的离子方程式 。
(4)若只用一种试剂即可将第②组物质区分开来,该试剂是 。
(5)第③组固体Y中混入了少量的Z,除去少量的Z的最好方法是 。
右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。
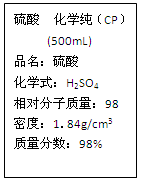
Ⅰ.硫酸具有A~D所示的性质,以下过程主要表现了浓硫酸的那些性质。
A.酸性 B.吸水性 C.脱水性 D.强氧化性
(1)浓硫酸可以干燥氢气____________________;
(2)浓硫酸使木条变黑____________________;
(3)热的浓硫酸与铜片反应______________。(填序号)
Ⅱ.现用该浓硫酸配制100 mL1.000mol/L的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒;⑧100mL容量瓶。请回答:
(1)配制稀硫酸时,上述仪器中需要使用的除①③⑤外,还有__________(填序号)。
(2)经计算,配制100mL1.000mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为__________mL。
(3)下列操作会使配制的溶液浓度偏高的是___________。
A.量取浓H2SO4时,俯视刻度线
B.定容时,俯视容量瓶刻度线
C.配置前,容量瓶中有水珠
D.定容后摇匀发现液面下降,但未向其中再加水
(1)如下图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到右瓶的现象是:__________,发生此现象的原因是__________。(用有关的方程式解释)
(2)为防止氯气尾气污染空气,根据氯气的性质,可用_________溶液吸收多余的氯气,原理是___________。(用化学方程式表示)根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,反应化学方程式为:_______________。长期露置于空气中的漂白粉,加稀盐酸后产生的气体是________(填序号)。
| A.O2 | B.Cl2 | C.CO2 | D.HClO |
用化学用语表达下列变化过程,其中(1)~(3)写化学方程式,(4)~(5)写离子方程式。
(1)金属钠与水反应______________________
(2)工业合成氨____________________________
(3)二氧化硫与硫化氢反应___________________________
(4)碳酸氢钠溶液与稀盐酸反应_______________________
(5)少量氯气通入碘化钾溶液中_______________________
氮元素可形成丰富多彩的物质。
(1)基态氮原子的价电子轨道表示式为______________;等物质的量的NH3和N2混合气体中σ键与π键的数目之比为___________________。
(2)光化学烟雾易在PM2.5尘粒的催化作用下形成,光化学烟雾中含有NOx、O3、CH2=CHCHO、HCOOH等二次污染物。下列说法正确的是__________________。
| A.N2O与CO2互为等电子体,其结构式为N=N=O |
| B.O3的沸点大于O2 |
| C.CH2=CHCHO分子中碳原子的杂化方式为sp2、sp3 |
| D.HCOOH在水中溶解度大的原因与氢键有关 |
(3)在配合物中,下列微粒NH3、NH4+、NH2OH不能作为配位体的有____________。
(4)图a为六方氮化硼晶体结构示意图,该晶体中存在的作用力有______________。


(5)六方氮化硼在高温高压下可转化为立方氮化硼,其晶胞结构如图b,晶胞边长为dcm,该晶胞中含有_________个氮原子、__________个硼原子,立方氮化硼的密度是__________g·cm-3(阿伏伽德罗常数的值为NA)
有机化学中的反应类型较多,将下列反应归类(填序号)。
①乙烷在空气中燃烧 ②由乙炔制氯乙烯
③甲烷与氯气在光照的条件下反应 ④乙烯使酸性高锰酸钾溶液褪色
⑤由乙烯制聚乙烯 ⑥乙烯使溴的四氯化碳溶液褪色
⑦实验室制乙烯 ⑧由甲苯制取TNT
⑨溴乙烷和氢氧化钠的乙醇溶液共热
⑩乙苯的制备: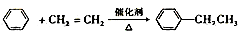
(1)其中属于取代反应的是__________;属于氧化反应的是_________;属于加成反应的是_________;属于消去反应的是_________;属于聚合反应的是___________
(2)写出⑧和⑨的化学方程式:
⑧____________________________________
⑨____________________________________
物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:

(1)Y的化学式为 ,检验Y所用的试剂是 。
(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为 。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是 (填序号)。
a.Na2S + S b.Na2SO3 + S c.Na2SO3 + Na2SO4 d.SO2 + Na2SO4
(4)将X与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为 。
按要求用化学用语回答下列问题:
(1)除去混入Fe2O3粉末中少量Al2O3杂质的试剂是 ,
离子方程式为 。
(2)在呼吸面具中,Na2O2 起反应的化学方程式为 。
(3)镁带着火时,不能用液态CO2灭火剂来灭火的原因是___ _。(用化学方程式表示).
(4)氯气用于漂白、消毒时,能起漂白、消毒作用的物质是_____ ____(写化学式).
某研究性学习小组对漂白液进行了如下实验探究:取漂白液少量,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,可以证明漂白液具有的性质有__________。
原电池和电解池都能实现能量的置换。回答下列问题:
(1)可将化学能转化为电能是_________池;
(2)下列反应能设计成原电池的是:
① 2FeCl3+Fe=3FeCl2
② AlCl3+3NH3·H2O= Al(OH)3↓+3NH4Cl
③ NaOH+HC1=NaC1+H2O
(3)用FeCl3溶液腐蚀印刷电路铜板的离子方程式为: 。
(4)右图装置当闭合电键时,电表显示有电流通过。则Pt极的电极反应式: ; 当甲中产生0.1 mol气体时,乙中析出铜的质量应为________g。

简要回答下列问题。
(1)氯化铵常用作除锈剂,其水溶液呈酸性的原因是_____________________。
(2)硫酸铝水解的离子方程式是_______________,为了抑制其水解,配制时可以加入少量的__________。
(3)泡沫灭火器中装的灭火剂主要包括硫酸铝溶液、碳酸氢钠溶液。泡沫灭火器内置的玻璃筒应装_______溶液,外部的铁筒装另一种溶液。
有机物A只含有C、H、O三种元素,常用作有机合成的中间体。16.8 g该有机物经燃烧生成44.0 g CO2和14.4 g H2O;质谱图表明其相对分子质量为84,红外光谱分析表明A分子中含有O-H键和-C≡C-H,核磁共振氢谱上有三个峰,峰面积之比为6∶1∶1。
(1)A的分子式是 。
(2)下列物质中,一定条件下能与A发生反应的是 。
a.H2 b.Na c.酸性KMnO4溶液 d.Br2
(3)A的结构简式是 。
(4)有机物B是A的同分异构体,能发生银镜反应,1 mol B最多能与2 mol H2加成。B中所有碳原子一定处于同一个平面,请写出所有符合条件的B的结构简式(不考虑立体异构) 、 。