某中性有机物A的化学式为C6H12O2,可发生如图所示变化: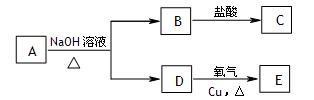
(1)若C、E均能发生银镜反应,则A的结构简式可能有:
、  、
、
、 。
(2)若C、E均不能发生银镜反应,则A的结构简式可能有:
_____________________________、 。
I.在实验室利用下列装置,可制备某些气体并验证其化学性质。
完成下列表格:
| 序号 |
气体 |
装置连接顺序(填字母) |
制备反应的化学方程式 |
| (1) |
乙烯 |
__________________ |
_________________________ |
| (2) |
乙炔 |
A→C→E |
_________________________ |
II. (1)工业上用乙烯和氯气为原料,经下列各步合成聚氯乙烯(PVC):
反应(2)的化学方程式是__________________________________________;
PVC的结构简式是_________________________________________________。
(2)石油被称为“工业血液”。A是从石油中得到的链状烃,相对分子质量为42。以A为原料,利用下述反应合成甘油,在方框内填上中间体的结构简式。

(10)[物质结构].甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学程式是 ___________________________________
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:___________________________________
(3)在一定条件下,甲与O2反应的化学方程式是 _______________________
(4)丁的元素符号是_________,它的核外电子排布式为 _______________________
(5)丁的氧化物的晶体结构与_________________ 的晶体结构相似。
将a mol的Na2O2和b mol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.
(1)当剩余固体为Na2CO3,排出气体为O2,H2O时,a与b的比值为________.
(2)当剩余固体为Na2CO3,NaOH,排出气体为O2,H2O时,a与b的比值为________.
(3)当a大于b时,剩余固体为________,排出气体为________.
(4)排出的O2和H2O为等物质的量时,则a与b的比值为________.
(11)下图中A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。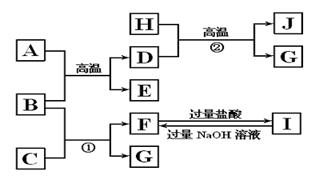
根据图示回答问题:
(1)写出下列物质的化学式:A_________,E _________ ,I _____________ ;
(2)反应①的化学方程式是 ______________________________;
反应②的化学方程式是 _______________________ ;
(3)J与盐酸反应的化学方程式是 __________________________ ;
反应后的溶液与D反应的化学方程式是 __________________________________。
储氢纳米碳管的成功研制体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种。
(1)请用上述物质填空,并配平化学方程式:
C+________+H2SO4——________+________+Cr2(SO4)3+H2O
(2)上述反应中氧化剂是________ (填化学式),
(填化学式), 被氧化的元素是________(填元素符号)。
被氧化的元素是________(填元素符号)。
(3)H2SO4在上述反应中表现出来的性质是(填选项序号)________。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为____。
甲是一种盐,由A、B、C、D、E五种元素组成,其中四种是短周期元素。甲溶于水后可电离出三种离子,其中一种离子是由A、B两元素形成的10电子阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中滴入KSCN溶液,无现象,再滴入氯水,溶液呈红色;
③取少量甲溶液于试管中加入足量NaOH溶液,加热,部分实验现象如下:产生有刺激气味的气体;
④取少量甲溶液于试管中,向其中加入稀盐酸,再加入BaCl2溶液,出现白色沉淀。
回答下列问题:
(1)C的元素符号是 ,D在周期表中的位置: 周期 族
(2)用离子方程式表示实验②中现象的原因: 。
(3)实验③中出现的现象还有 。
(4)经测定甲晶体的摩尔质量为284 g/mol,其中阳离子与阴离子物质的量之比为3:2,则甲晶体的化学式为 。
下图是中学常见物质间的转化关系。已知:
①A为淡黄色固体,B为导致“温室效应”的主要物质; ②E为常见金属,J为红褐色沉淀;
③G在实验室中常用于检验B的存在;④L是一种重要的工业原料,常用于制造炸药,浓溶液常呈黄色,储存在棕色瓶中。
回答下列问题:
(1)A的电子式____________________________________________________。
(2)反应①的化学方程式为 ,反应②的离子方程式为 ,
(3)若参加反应的A的质量为39g,则消耗CO2的体积(标况下)为 L。
(4)L的化学式 ,G的化学式 。
(每空2分,共18分)在实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应: 2A(g)+ B(g)2C(g);△H=QkJ/mol
B(g)2C(g);△H=QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
 实验 实验序号 |
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
8 0 0 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
8 0 0 ℃ |
n2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
8 0 0 ℃ |
n3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
7 3 0 ℃ |
1.0 |
0.90 |
0.80 |
0.75 |
0.70 |
0.65 |
0.65 |
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc= mol/(L·min);实验2中采取的措施是 ;实验3中n3 1.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q_ 0(填“>、=、<”),理由是_
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如右图所示,根据图中所示判断下列说法正确的__ __。
a.10~15 min可能是升高了温度
b.10~15 min可能是加入了催化剂
c.20 min时可能是缩小了容器体积
d.20 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA (g)和3molB(g),此时容器的压强为P(始
(g)和3molB(g),此时容器的压强为P(始 )。
)。
反应进行并达到平衡后,测得容器内气体压强为P(始)的 。若相同条件下,向上述
容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压
强仍为P(始)的 。
①a、b、c必须满足的关系是 , 。
(一个用a、 c表示,另一个用b、c表示)
c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是 。
气体化合物A是一种不稳定的物质,它的分子组成可用OxFy表示。10mLA气体能分解生成15mLO2和10mLF2(同温同压下),则A的化学式是 ,推断的依据是 和 。
下表是不同温度下水的离子积数据:
| 温度/℃ |
25 |
t1 |
t2 |
| Kw/ mol2·L-2 |
1×10-14 |
a |
1×10-12 |
试回答以下几个问题:
(1)若25< t1< t2,则a 1×10-14(填“<”、“>”或“=”),由此判断的理由是: 。
(2)在t1℃下,pH=10的NaOH溶液中,水电离产生的[OH-]为: 。
(3)在t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的硫酸溶液V2 L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=2,则V1︰V2 = ,此溶液中各种离子的浓度由大到小的顺序是 。
在常温下,下列五种溶液:
①0.1mol/L ②0.1mol/L
②0.1mol/L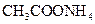 ③0.1mol/L
③0.1mol/L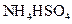
④0.1mol/L 和0.1mol/L
和0.1mol/L 混合液 ⑤0.1mol/L
混合液 ⑤0.1mol/L
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)
(2)在上述五种溶液中, 最小的是 ;
最小的是 ; 最小的是 (填序号)
最小的是 (填序号)
(3)比较溶液②、③中 的大小关系是② ③(填“>”、“<”或“=”)
的大小关系是② ③(填“>”、“<”或“=”)
(4)在溶液④中, 离子的浓度为0.1mol/L; 和 离子的物质的量浓度之和为0.2mol/L。
和 离子的物质的量浓度之和为0.2mol/L。
(5)常温下,测得溶液②的 ,则说明
,则说明 的水解程度 (填“>”、“<”或“=”)
的水解程度 (填“>”、“<”或“=”) 的水解程度,
的水解程度, 与
与 浓度的大小关系是:
浓度的大小关系是:
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= ;
(2)该反应为 反应(选填吸热、放热);
(3)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为 ℃;
(4)830℃时,向该容器中加入1L CO2与1L H2 ,平衡时CO2的体积分数是 。
已知 为难溶于水和酸的白色固体,
为难溶于水和酸的白色固体, 为难溶于水和酸是黑色固体。向
为难溶于水和酸是黑色固体。向 和水的悬浊液中加入足量的
和水的悬浊液中加入足量的 溶液并振荡,结果白色固体完全转化为黑色固体:
溶液并振荡,结果白色固体完全转化为黑色固体:
(1)写出白色固体转化黑色固体的化学方程式: ;
(2)白色固体转化成黑色固体的原因是: 。
已知在下图转化关系(某些转化关系中的产物已略去)中都是中学化学常见的物质,物质A、D、G是单质,磁性黑色物质C是某金属矿物的主要成份,E是一种非氧化性酸,F是混合物,H是极易溶于水的碱性气体。
请回答下列问题:
(1)写出下列物质的化学式:A 、C 、I
(2)写出反应①的化学方程式:
写出生成混合物F的离子方程式:
(3)在一定温度、压强和有催化剂存在的条件下将l mol G和2,5 mol D放入500mL密闭容器中。经过20min达到平衡,平衡后H的浓度为2mol/L,
①则用G表示20min内的平均反应速率为:____
该温度下此反应的平衡常数K= ,D的转化率为
②如果保持温度不变,再向容器中同时充入1.5 mol G和1 mol H,D的转化率将 (填“升高”、“不变”或“降低”),再次平衡后H的体积分数为____ 。