某化学兴趣小组用铁矿石(主要成分为Fe2O3,还有较多的SiO2、Al2O3及少量的不溶于酸的杂质)提取Fe2O3。操作过程如下:
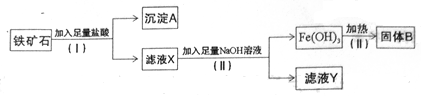
(1)(Ⅰ)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是 ;
(2)写出沉淀A中含量最多的物质与NaOH溶液反应的离子方程式: ;
(3)取少量滤液X于试管中滴入几滴KSCN溶液可观察到溶液变成 色。反应的离子方程式为: ,滤液Y中的阴离子有 种;
(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式 ;
某地煤矸石经预处理后含SiO2、Al2O3、Fe2O3,一种综合利用煤矸石制取绿矾(FeSO4·7H2O)的工艺流程如下图所示。
(1)过滤操作需要用到的玻璃仪器除了烧杯、玻璃棒还有_____________。
(2)写出所选试剂X、Y的化学式:X_______________,Y_____________。
(3)滤液B中含的阴离子有_____________(写离子符号)。
(4)滤渣SiO2可制取木材防火剂,该防火剂的化学式为______________。
(5)由溶液D转化为溶液E的离子方程式为:______________。
(6)根据图中数据,计算出原40g煤矸石中Fe2O3的质量分数为_____________。(假设适量均为恰好反应)
汽车尾气、燃煤尾气、地面灰尘等污染物是造成空气污染的主要原因。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)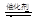 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
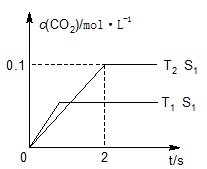
①该反应的ΔH________0(填“>”“<”)。
②在T2温度下,0~2 s内的平均反应速率v(N2)=___________。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
④若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是___________(填代号)。

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH1=-867 kJ/mol
2NO2(g)=N2O4(g)ΔH=-56.9 kJ/mol
写出CH4(g)催化还原N2O4(g)生成N2(g)和H2O(g)的热化学方程式_____________。
(3)已知反应:CO2(g)+H2(g)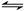 CO(g)+H2O(g),现将不同量的CO2(g)和H2(g)分别通入到容积为2L的恒容密闭容器中进行反应,得到如下两组数据:
CO(g)+H2O(g),现将不同量的CO2(g)和H2(g)分别通入到容积为2L的恒容密闭容器中进行反应,得到如下两组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡 所需时间/min |
||
| CO2(g) |
H2(g) |
H2O(g) |
CO2(g) |
|||
| 1 |
650 |
2 |
1 |
0.4 |
1.6 |
6 |
| 2 |
900 |
4 |
2 |
1.6 |
2.4 |
2 |
①实验1条件下平衡常数K=____________(保留小数点后二位)。
②该反应的ΔH____________0(填“<”或“>”)。
乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
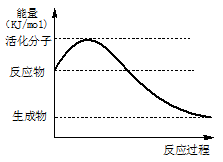
(1)CaC2中C2- 2与O2+ 2、N2互为等电子体,O2+ 2的电子式可表示为 ;1mol O2+ 2中含有的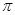 键为 mol。
键为 mol。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是 、 。
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如右图所示),但CaC2晶体中有哑铃形的C2- 2存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离相等且最近的C2- 2数目为 。

氨和水都是常用的试剂。请回答下列问题:
(1)氮元素在元素周期表中的位置是 ;基态氮原子的核外电子中,未成对电子数与成对电子数之比为____________。
(2)NH3分子可结合一个H+形成铵根离子(NH)。
①NH3分子中N原子的杂化类型是____________。
②NH3分子与H+结合的过程中未发生改变的是____________(填选项字母)。
A.微粒的空间结构 B.N原子的杂化类型 C.H—N—H的键角
(3)将氨气通入CuSO4溶液中,产生蓝色沉淀,继续通过量氨气,沉淀溶解,得到蓝色透明溶液。[Cu(H2O)6]2+(水合铜离子)和[Cu(NH3)4]2+中共同含有的化学键类型是 。生成蓝色沉淀的离子方程式是 。
(1)右图是某化学反应中的能量变化图。
①该反应是 (填“吸热”或“放热”)反应。
②请在图中画出该反应的活化能E和反应热ΔH,并作相应标注。
③催化剂在实际生产中往往起关键作用,使用催化剂能改变反应速率的原因是。
(2)已知生成1mol H-H键,1molN-H键,1molN≡N键分别放出的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为______________。
(3)473K,101KPa时,把1mol H2和1mol I2放在某密闭容器中进行反应,热化学方程式如下:H2(g)+I2 (g) 2HI(g) ΔH=-14.9kJ/mol,测得反应放出的热量总是小于14.9kJ,其原因是 。
2HI(g) ΔH=-14.9kJ/mol,测得反应放出的热量总是小于14.9kJ,其原因是 。
H2S是一种无色、有臭鸡蛋气味、有毒的可燃性气体,高温下可以分解,其水溶液叫氢硫酸(二元弱酸,较强还原性)。
(1)用30% FeCl3溶液作吸收液能吸收H2S气体,反应方程式为:2FeCl3+H2S=S↓+2FeCl2+2HCl,废吸收液经电解可循环使用。
①该反应中H2S显 (填字母代号)。
a、不稳定性 b、弱酸性 c、氧化性 d、还原性
②检验废吸收液中是否含有Fe3+的适宜试剂是 ;反应的离子方程式是 。
③强酸性的废吸收液电解可生成FeCl3和一种分子量最小的气体,则该反应的化学方程式是 。
(2)已知:H2S在高温下分解生成硫蒸气和H2。现测得某温度下,H2S分解过程中各物质的物质的量随时间变化关系如右图所示。

①表示H2的曲线是 (填“A”、“B”或“C”)。
②生成硫蒸气的分子式为 。
(1)将117 g NaCl溶于水配制成1 L溶液,该溶液中NaCl的物质的量浓度为 。
(2)在标准状况下,将V L A气体(摩尔质量为M)溶于0.1 L水中,所得溶液的密度为,则此溶液的物质的量浓度为 。
(3)某硫酸溶液的物质的量浓度为c1,密度为ρ1;另一种硫酸溶液的物质的量浓度为c2,密度为ρ2,将它们等体积混合后,所得溶液的密度为ρ3,则混合后硫酸的物质的量浓度为 。
A.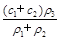 |
B.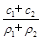 |
C.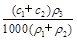 |
D.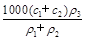 |
(1)甲醇是一种可再生能源,用途广泛,一种由甲醇、氧气以及强碱溶液制成的新型手机电池,容量达氢镍电池或锂电池的10倍。回答下列有关问题:

如图所示:
①甲池通入CH3OH的电极反应式为 ;乙池石墨一极的电极反应式为 ;
②反应一段时间后,向乙池中加入一定量 能使CuSO4溶液恢复到原浓度;
③甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生 g沉淀。
(2)工业上有一种生产甲醇的反应:
CO2(g) + 3H2(g) CH3OH(g) + H2O(g) △H=-49.0kJ·mol-1
CH3OH(g) + H2O(g) △H=-49.0kJ·mol-1
在某温度下,容积均为2L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
| 容器 |
A |
B |
| 反应物投入量 |
1mol CO2(g)和3mol H2(g) |
1mol CH3OH(g)和1mol H2O(g) |
| CH3OH(g)浓度(mol•L-1) |
c1 |
c2 |
| 反应能量变化 |
放出29.4kJ |
吸收akJ |
①从反应开始至达到平衡时,A中用CO2来表示的平均反应速率为 ;
②该温度下,反应CO2( ) + 3H2(
) + 3H2( )
) CH3OH(
CH3OH( ) + H2O(
) + H2O( ) 的化学平衡常数的值为 ;
) 的化学平衡常数的值为 ;
③a= 。
④下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入氢气
C.将水蒸气从体系中分离 D.用更有效的催化剂
根据下图填空:
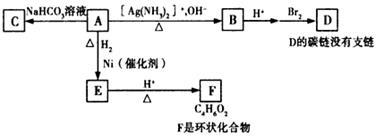
已知:1 mol A与2 mol H2反应生成1 mol E
(1)化合物A含有的官能团名称是 。
(2)B在酸性条件下与Br2反应得到D,写出D与足量NaOH溶液反应的化学方程式是 。
(3)与A具有相同官能团的A的同分异构体的结构简式是 。
(4)写出E的结构简式 。
(5)写出A→B的化学方程式 。
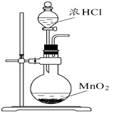
下列有关实验的选项正确的是
| A.配制0.10mol/L NaOH溶液 |
B.除去CO中的CO2 |
C.实验室制取氯气 |
D.蒸干NH4Cl溶液制备NH4Cl晶体 |
 |
 |
 |
 |
电解质水溶液中可存在电离平衡,水解平衡,溶解平衡,依据所学回答下列问题。
(1)等物质的量浓度的下列四种溶液:①NH3·H2O ②(NH4)2SO3③KHSO3④K2SO3溶液中水的电离程度由大到小的排列顺序为________________(填序号)。
(2)体积相同、c(H+)相同的三种酸溶液①CH3COOH;②HCl;③H2SO4分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是(填序号) _____________。将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为_____________(填序号)。
(3)已知,H+ (aq) + OH-(aq) ="=" H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为____________。
(4)25℃时,NH3·H2O的电离常数为Kb=1.7×10-3。0.1mol·L-1NH4Cl溶液的pH=a,则c(NH4+)∶c(NH3·H2O)=_________(用含a的代数式表示)
(5)某化学研究性学习小组对电解质溶液作如下归纳总结(均在常温下),其中正确的有( )
①pH=1的强酸溶液,加水稀释后,溶液中各离子浓度一定都降低
②pH=2的盐酸与pH=13的NaOH溶液,按体积比9:1混合后的溶液pH为11
③pH相等的三种溶液:a.CH3COONa;b.NaHCO3;c.NaOH.其溶液物质的量浓度由小到大顺序为c、b、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42﹣)
⑤亚磷酸(H3PO3)是二元弱酸,所以Na2HPO3稀溶液一定呈碱性
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7.
⑦某二元酸在水中的电离方程式是H2B═H++HB﹣;HB﹣ H++B2﹣,则0.1mol/L的Na2B溶液中,c(Na+)=2c(B2﹣)+2c(HB﹣)
H++B2﹣,则0.1mol/L的Na2B溶液中,c(Na+)=2c(B2﹣)+2c(HB﹣)
(6)25℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20,
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33。在25℃下,向浓度均为0.1mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2mol·L-1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。
甲醇是重要的化工原料,利用CO2和H2合成甲醇,发生的主反应如下:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H

已知:在25℃、101kPa 下,1g 甲醇燃烧生成 CO2和液态水时放热 22.70kJ.请写出表示甲醇燃烧热的热化学方程式 .
(1)在一恒温恒容密闭容器中充入1mol CO2和3mol H2进行上述反应.测得CO2和CH3OH(g)浓度随时间变化如图1所示.回答:
0~10min 内,氢气的平均反应速率为 mol/(L•min);第10min 后,保持温度不变,向该密闭容器中再充入0.75mol CO2(g)和1.5mol H2O(g),则平衡 (填“正向”、“逆向”或“不”)移动.恒温恒压密闭容器中该反应达平衡状态的依据是(填序号) .
| A.v正(CH3OH)=3v逆(H2) | B.混合气体的密度不变 |
| C.c(CH3OH)=c(H2O) | D.混合气体的总物质的量不变 |
(2)如图2,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解300mL某NaCl溶液,该装置中 a 极为 极,负极反应式为 .在电解一段时间后,NaCl溶液的pH值变为12(假设NaCl 溶液的体积不变),则理论上消耗甲醇的物质的量为 mol.
(3)取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图3所示,则上述CO2转化为甲醇的反应的△H 0(填“>”、“<”或“=”).
已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
①上述盐溶液中的阴离子,结合质子能力最强的是______________
②根据表中数据判断,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是____________;(填编号,下同)将各溶液分别稀释100倍,pH变化最小的是__________
A HCN B HClO C C6H5OH D CH3COOH E H2CO3
③据上表数据,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
(2)CaCO3是一种难溶物质,其KSp=2.8×l0-9。现将浓度为2×l0-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为___________mol/L。
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理______________________。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是_________(填序号)
A.Ba(NO3)2 B.BaCl2
C.Ba(OH)2 D.溶有NH3的BaCl2溶液
③已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是___________。
(2)电解法处理酸性含铬废水(主要含有Cr2O72-)时,在废水中加入适量NaCl,以铁板作阴、阳极,处理过程中存在如下反应Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+ 以Cr(OH)3形式除去,下列说法不正确的是______(填序号)
A.阳极反应为Fe-2e-═Fe2+
B.电解过程中溶液pH减小
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有2mol Cr2O72-被还原
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。右图是该燃料电池示意图,产生的X气体可直接排放到大气中,a电极作_________极(填“正”“负”“阴”或“阳”),其电极反应式为___________。
