某化学反应的反应物和产物如下:
10Al+6NaNO3+6H2O =4 Al(OH)3+3N2↑+6 NaAlO2
①该反应的氧化剂是 .
②该反应的氧化产物是 .
③反应过程中转移5mol电子,生成标准状况下N2的体积为 L.
④用单线桥表示该反应的电子转移的方向和数目
下列物质能导电的是 ;属于电解质的是 ;属于非电解质的是 (填编号)。
①HCl气体、② NH3、③熔融的NaOH 、④SO2、⑤Cu 、 ⑥氨水 ⑦KNO3溶液 、⑧液态醋酸 、⑨蔗糖、⑩硫酸钡固体
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
| T/℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应为 反应(填“吸热”、“放热”)。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出CO气体 b.适当升高温度
c.增大CO2的浓度 d.选择高效催化剂
(3)能判断该反应已达到化学平衡状态的依据是 。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为 ℃。
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为 mol,CO的体积分数为 。
(1)下列物质中能导电的是 ,属于强电解质的是 ,
①H2SO4,②熔融硫酸钠,③ NH3•H2O,④ CO2,⑤碳酸钙,⑥ CH3COOH,⑦氯气,⑧石墨.
(2)某温度下,将50mL 0.2mol/L MgCl2溶液与50mL 0.2 mol/LNaOH溶液充分混合。经判断: (选填有或无)沉淀生成,依据是 (已知此温度下KSP[Mg(OH) 2]=1.8 10
10 )
)
(3)常温下,0.lmol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=或“<”),原因是 (用恰当的化学用语和必要的文字说明回答)。
X、Y、Z、Q、R、T分别代表原子序数依次增大的短周期元素。X、Y、Z同周期且相邻, 都是蛋白质的组成元素;X、T同族,Q与R原子的最外层电子数之和与T原子的最外层电子数相等。U是d区元素,U2+的核外最高能级有2对成对电子。
都是蛋白质的组成元素;X、T同族,Q与R原子的最外层电子数之和与T原子的最外层电子数相等。U是d区元素,U2+的核外最高能级有2对成对电子。
请回答下列问题:
(1)Q原子的核外电子排布式为 。
(2)XZ2的分子中σ键与π键数目之比为 ,YZ2-离子的VSEPR模型名称是 。
(3)Q、R、T的单质形成的晶体中,熔点由高到低的顺序是 (填化学式),既能与强酸反应,又能与强碱反应的是 (填化学式)。
(4)通常情况下,U2+的溶液很稳定,它与YH3形成的配位数为6的配离子却不稳定,在空气中易被氧化为 [U(YH3)6]3+,该反应的离子方程式是 。
0.1mol/L的NaHCO3溶液中
(1)按物质的量浓度由大到小顺序排列该溶液中各种离子浓度
(2)c(Na+)+c(H+)==
(3)c(Na+)==
(1)FeCl3的水溶液呈____________(填“酸”“中”或“碱”)性,原因是__________(用离子方程式表示):;实验室在配制.FeCl3溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以________(填“促进”或“抑制”)其水解
(2)25 °C时,0.1 mol·L-1NH4Cl溶液的pH__________7(填“<”、“=”或“>”),其原因是__________________(用离子方程式表示);
(3)泡沫灭火器灭火原理____________________(用离子方程式表示)
(4)纯碱可代替洗涤剂洗涤餐具,原因是________________(用离子方程式表示):.
现有NH4Cl和氨水组成的混合溶液。请回答下列问题(填“>”、“<”或“=”):
(1)若溶液的pH=7,则该溶液中c(NH )_________c (Cl—)。
)_________c (Cl—)。
(2)若溶液的pH>7,则该溶液中c(NH+)_________c(Cl—)。
(3)若c(NH )<c (Cl—),则溶液的pH__________7。
)<c (Cl—),则溶液的pH__________7。
在密闭容器里,通入x mol H2(g)和y mol N2(g),发生反应3H2(g)+N 2(g)  2 NH3 (g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”),平衡将如何改变?(填“左”“右”或“不移动”)
2 NH3 (g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”),平衡将如何改变?(填“左”“右”或“不移动”)
(1)升高温度 , ;(2)加入催化剂 , ;
(3)充入更多的H2 , ;(4)扩大容器的体积 , ;
(5)容器容积不变,通入氖气 , 。
除去下列不纯物质中的少量杂质(括号内为杂质),请填入适当的试剂
(1)Cu(Al)_________________(2)Fe2O3(Al2O3)___________________
(3)NO(NO2)__________________(4)NaCl溶液(Na2CO3)_______________
按要求完成下列各题。
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为: 。
(2)ClO2常用子水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式: 。
(3)MnO2可与KOH和KClO3在高温条件下反应,生成K2MnO4,反应的化学方程式为: 。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为 。
(4)(CN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为 。
无机化合物可根据其组成和性质进行分类:

(1)上述所示的物质分类方法名称是 。
(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②、③和⑥后面。(每空填写一个化学式即可)
| 物质类别 |
酸 |
碱 |
盐 |
氧化物 |
| 化学式 |
①HCl ② |
③ ④Ba(OH)2 |
⑤Na2CO3 ⑥ |
⑦CO2 ⑧Na2O2 |
(3)二氧化碳与氢氧化钠溶液反应的离子方程式为____________。
(4)过氧化钠可作供氧剂,原因是_______(用化学方程式表示)。
反应A(g)+ B(g) C(g) +2D(g)的能量变化如下图所示,回答下列问题。
C(g) +2D(g)的能量变化如下图所示,回答下列问题。
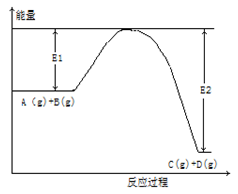
(1)该反应是 反应(填“吸热”“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率 (填“增大”“减小”“不变”下同),原因是 ;
(3)向体系中加入催化剂,△H ;
(4)将1molA和2molB加入2L容器中,5min后达到平衡,此时A的转化率为50%,则5min内用D表示化学反应速率为 ,平衡常数K= 。
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” )。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” )
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。(填“ >” 或“=”或“<” )
⑴有下列四种溶液:①100mL 0.1mol/L H2SO4溶液;②100mL 0.15mol/L HCl溶液 ③100mL 0.2mol/L CH3COOH溶液;④200mL 0.1mol/L CH3COOH溶液。
其中pH最小的是 (填序号,下同),由水电离的H+浓度最大的是 ,与足量的Zn反应,生成H2最少的是 ;①和③分别与100mL 0.2mol/L NaOH溶液反应,放出热量少的是 ,理由是 。
⑵实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。该学生取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定。滴定达到终点的标志是 ;在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________(填字母序号)。
| A.滴定终点读数时俯视 |
| B.酸式滴定管使用前,水洗后未用待测盐酸润洗 |
| C.锥形瓶水洗后未干燥 |
| D.称量NaOH固体中混有Na2CO3固体 |
E.碱式滴定管尖嘴部分有气泡,滴定后消失