随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
Ⅰ.目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3.25 mol H2,在一定条件下发生反应,测定CO2、CH3OH(g)和H2O(g)的浓度随时间变化如下图所示:

(1)从反应开始到平衡,氢气的平均反应速率 = mol/(L·min)
= mol/(L·min)
(2)该条件下CO2的转化率为 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 。
| A.升高温度 |
| B.恒容时充入氮气 |
| C.将水蒸气从体系中分离 |
| D.用更有效的催化剂 |
Ⅱ.下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:[Ag:108]

(1)M极的电极材料为 。
(2)加入乙醇的铂电极的电极反应式为
(3)在此过程中乙池中某一电极析出金属银4.32g时,此时乙池 溶液的体积为400mL,则乙池中溶液的pH为 。
(4)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出 29.71kJ热量,表示该反应的热化学方程式为 。
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,原因是(用离子方程式表示)________________________。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的目的是___________________。
(3)某小组同学探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。打开活塞向烧瓶中的NaClO加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。出现上述现象的原因是__________________________(请用反应的离子方程式表示)。
(4)25℃时,0.1 mol/L的HA溶液中c(H+)/c(OH-)=1010。请回答下列问题:
(a)在加水稀释HA溶液的过程中,随着水量的增加而增大的是 (填字母)。
A.c(H+)/c(HA) B.c(HA)/(A-) C.c(H+)与c(OH-)的乘积 D.c(OH-)
(b)NaA溶液显________(填“酸性”、“中性”或“碱性”),
石油化工的重要原料CxHy可以合成很多有机化合物,以下是CxHy合成物质E和J的流程图:

已知:Ⅰ.下列反应中R、R′代表烃基
Ⅱ.J的分子式为C4H4O4,是一种环状化合物。
(1)在CxHy的同系物中,所有碳原子一定共平面且碳原子数最多的分子的名称是____ 。
(2)H的分子式是 。
(3)下列说法正确的是 。
a.CxHy和苯都能使溴水褪色,原理相同
b.反应②和反应④的反应类型均为加成反应
c.C能与Na、NaOH、NaHCO3反应
d.E是一种水溶性很好的高分子化合物
e.J在酸性或碱性环境中均能水解
(4)K是J的同分异构体,且1molK与足量的NaHCO3溶液反应可放出2molCO2气体,请写出一种符合条件K的结构简式__ 。
(5)写出反应⑤的化学方程式 ________。
(6)D有多种同分异构体,与D具有相同官能团的还有 种(含顺反异构体),其中核磁共振氢谱有3组吸收峰,且能发生银镜反应的结构简式是 。
(1)下列有关说法正确的是
A.可用石灰水区分Na2CO3与NaHCO3溶液;
B.HClO4的酸性强于H2SO3,所以非金属性:Cl﹥S;
C.配制0.2 mol·L-1的Na2CO3溶液480mL,需称量10.6g Na2CO3固体;
D.金属钠着火时,可用泡沫灭火器来灭火;
E.强酸可以制弱酸,弱酸通过化学反应一定不能生成强酸;
F.过量的Zn和浓硫酸反应,生成标准状况下气体22.4L,转移电子一定是2mol;
G.SO2使品红溶液褪色和使KMnO4溶液褪色都体现了其漂白性。
(2)某透明溶液仅含Na+、Fe2+、Ba2+、Al3+、NO3-、Cl-、SO42-中的4种离子,所含离子均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。回答下列问题:
①溶液中存在的离子是 ;
②写出溶液中加入过量的稀硫酸反应的离子方程式____________________;
③向原溶液中滴加足量NaOH溶液后,过滤洗涤灼烧,最终得到固体质量为 g。
(3)磷的一种化合物叫亚磷酸(H3PO3)。已知:
Ⅰ、0.1 mol/L H3PO3溶液的pH = 1.7;
Ⅱ、H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐;
Ⅲ、H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。
关于H3PO3的说法:①强酸;②弱酸;③二元酸;④三元酸;⑤氧化性酸;⑥还原性酸,其中正确的是 。
A.②④⑥ B.②③⑥ C.①④⑤ D.②③⑤
写出H3PO3与过量NaOH溶液反应的离子方程式 。
铁及其化合物在生产、生活中有广泛应用.请回答下列问题:
(一)高炉炼铁过程中发生的主要反应为:
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)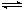
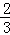 Fe(s)+CO2(g)
Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数 如下:
温度/℃ 1000 1115 1300
平衡常数 4.0 3.7 3.5
(1)该反应的平衡常数表达式K=___;△H___0(填“>”、“<”或“=”).
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是_____.
| A.提高反应温度 | B.移出部分CO2 |
| C.加入合适的催化剂 | D.减小容器的容积 |
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正___υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=_____.
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是_____;生成1mol K2FeO4转移电子的物质的量是_____mol.
某溶液A中可能含有NH4+、Fe3+、Al3+、Fe2+、CO32-、NO3-、Cl-、SO42-中的几种离子,且溶液中各离子的物质的量浓度均为0.1mol.L-1。现取该溶液进行如下实验:

(1)溶液A中一定不存在的离子为 (填离子符号)。
(2)溶液A中加入(NH4)2CO3,生成白色沉淀甲和气体甲的原因是 。
(3)白色沉淀乙的成分为 (填化学式)。
(4)为了进一步确定溶液A中是否含有NH4+,另取10ml该溶液,向其中滴加NaOH溶液,沉淀的物质的量随NaOH溶液体积的变化如图所示。

据图回答:
①溶液A中 (填“含有”或“不含有”)NH4+
②所加NaOH溶液的物质的量浓度为 mol.L-1
③若在A溶液中改加10ml0.2mol.L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为 mol
运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01mol.L-1)溶液的PH和原子序数的关系如下图所示。

(1)元素R在周期表中的位置是 。
(2)元素Y和W形成的Y2W2型化合物中含有化学键的类型为 。
(3)测定Z元素最高价氧化物对应水化物溶液物质的量浓度的方法为 。
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等
(1)下列能说明碳、硫两种元素非金属性相对强弱的是 (填序号)
A.相同条件下水溶液的PH:Na2CO3 >Na2SO4
B.酸性:H2SO3 >H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
(2)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似
①羰基硫(COS)的电子式为: 。
②羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下:

已知A是一种正盐,则A的化学式为 ;若气体a为单质,反应 II的离子方程式为 。
为了保护坏境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(Fe主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。

活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(S04)3+8H2O=15FeSO4+8H2SO4,不考虑其它反应,请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全被还原,应选择 (填字母编号)。
A.KMnO4溶液 B.KCl溶液 C.KSCN 溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质被除尽,通入空气引起溶液pH降低的原因是 。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s)△H=﹣1648kJ/mol
C(s)+O2(g)=CO2(g)△H=﹣393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)△H=﹣1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(5)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2=Fe+2Li2S,正极反应式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为50%,将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其它杂质浸出消耗的硫酸以及调pH后溶液呈微酸性,所残留的硫酸忽略不计,按上述流程,第Ⅲ步应加入FeCO3 kg
【化学—选修5有机化学基础】
物质A(C5H8)是形成天然橡胶的单体,它的一系列反应如下图所示(部分反应条件略去):

请按要求回答下列问题:
(1)反应①和③的反应类型分别是_____________、_____________。
(2)B的分子式为_________________;B形成高聚物的结构简式为_______________________。
(3)反应②的化学方程式为________________________。
(4)C为一溴代物,分子中含 均2个,反应④的化学方程式为_____________________。
均2个,反应④的化学方程式为_____________________。
(5)A的名称是______________________。
写出所有符合下列条件的A的同分异构体的结构简式:____________________
①环状 ②核磁共振氢谱显示有2种氢原子 ③不含立体异构________________________。
已知某植物精油中含有甲、乙、丙三种成分:
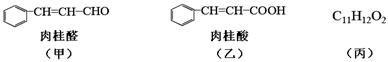
化合物甲可从桂皮油中提取,工业上可采用乙烯与甲苯为主要原料,按下列路线合成:
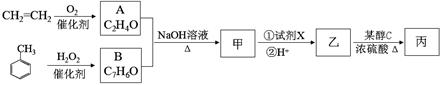
已知:A、B都能发生银镜反应。
回答下列问题:
(1)乙中官能团的名称为 。
(2)化合物丙的结构简式为 。
(3)写出A+B→甲的化学方程式 。
(4)试剂X是 ,乙→丙的反应类型是 。
(5)含有苯环结构且与甲同类型的同分异构体有 种(不考虑立体异构)。
水是最常用的溶剂,许多化学反应都需要在水溶液中进行。请仔细分析并回答下列各题。
(1)用0.1mol/LNaOH溶液滴定体积均为20.00mL、浓度均为0.1mol/L盐酸和醋酸溶液,得到如下所示滴定曲线图: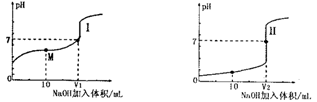
①用NaOH 溶液滴定醋酸溶液通常所选择的指示剂为________,符合其滴定曲线的是_______(填“I”或“II”);
②滴定前的上述三种溶液中,由水电离出的c(H+)最大的是_________溶液(填化学式);
③图中v1和v2大小的比较:v1_______v2 (填“>”、“<”或“=”);
④图I中M 点对应的溶液中,各离子的浓度由大到小的顺序是______________。
(2)某同学为了研究难溶电解质的溶解平衡,设计了如下实验(相关数据测定温度及实验环境均为25 ℃ ):
| 操作步骤 |
现象 |
| 步骤1:向20mL0.05mol/LAgNO3溶液中加入20mL0.05mol/LKSCN溶液,充分反应后过滤 |
出现白色沉淀 |
| 步骤2:向滤液中加少量2mol/LFe(NO3)3溶液 |
溶液变红色 |
| 步骤3:向步骤2所得溶液中,加入少量3mol/LAgNO3溶液 |
现象a |
| 步骤4:取步骤1所得少量滤渣加入到适量的3mol/LKI溶液中 |
出现黄色沉淀 |
查阅资料:AgSCN是白色沉淀:Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17.
① 请结合化学用语和必要的文字解释步骤2 现象出现的原因:____________________。
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为______________(任写一点即可)。
③ 写出步骤4 中沉淀转化反应平衡常数的表达式:K=__________。
某学习小组依据反应:SO2(g)+ Cl2(g) SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如图甲,有关信息如表所示。
SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如图甲,有关信息如表所示。
| |
SO2Cl2 |
Cl2 |
SO2 |
| 熔点/℃ |
–54.1 |
–101 |
–72.4 |
| 沸点/℃ |
69.1 |
–34.6 |
–10 |
| 性质 |
遇水发生剧烈水解 |
|
|
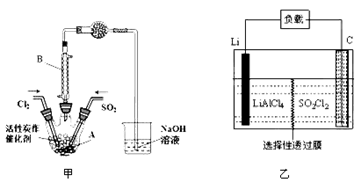
(1)若用浓盐酸与高锰酸钾为原料制取Cl2,反应的离子方程式为______________;
(2)B仪器的作用是________________;
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择_____。
A.冰水浴 B.常温 C.加热至69.1℃ D.沸水浴
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为____。
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应。充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收。分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W。经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式___________________。
(6)GET公司开发的Li-SO2Cl2军用电池,其示意图如图乙所示,已知电池反应为:2Li+SO2Cl2 = 2LiCl+SO2,则电池工作时,正极的电极反应式为__________________。
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1)写出该反应的化学方程式 。
(2)印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。

学科Ⅰ、步骤②需加入的试剂A是 (填化学式);
Ⅱ、步骤③通入的气体B是 (填化学式),写出该反应的离子方程式: 。
高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,离子方程式如下(未配平):
MnO4-+ Fe2++ H+ = Mn2++ Fe3++ H2O。下列说法正确的是
| A.MnO4-是氧化剂,Fe3+是还原产物 |
| B.Mn2+的还原性强于Fe2+ |
| C.离子方程式中按物质顺序的化学计量数是:1、5、8、1、5、4 |
| D.生成1 mol 水时,转移2.5 mol电子 |
向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的 CO2后,再稀释到100mL。
(1)在 NaOH 溶液中通入一定量的 CO2后,溶液中溶质的可能组成是①NaHCO3 ②Na2CO3 ③NaOH、Na2CO3 ④______________。
(2)在稀释后的溶液中逐滴加入0.1mol/L的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示:

①A曲线表明,原溶液通入CO2后,所得溶质与盐酸反应产生CO2的最大体积是 mL(标准状况)。
②原NaOH溶液的物质的量浓度为_________。