现有十种物质:①铁单质 ②石墨 ③氯气 ④硫酸钡晶体 ⑤纯硫酸 ⑥盐酸 ⑦澄清石灰水 ⑧乙醇 ⑨熔化的硝酸钾 ⑩FeCl2溶液
(1)其中能导电的是 ,属于电解质的是 。
(2)请写出下列反应的离子方程式:
①与⑥反应: 。
③与⑦反应: 。
(3)H2O2能与酸性FeCl2溶液反应,请配平其化学方程式,标出电子转移的方向和数目。
HCl+ H2O2+ FeCl2= FeCl3+ H2O
其中被还原的元素是 ,氧化产物是 ,当生成9g的水时,反应转移 mol电子。
据报道,苹果公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。下图是电化学过程的示意图。

已知甲池的总反应式为:2CH3OH+3O2+4KOH K2CO3+6H2O,请填空:
K2CO3+6H2O,请填空:
(1)充电时:①原电池的负极与电源______极相连,②阳极的电极反应为________。
(2)在此过程中若完全反应,乙池中B极的质量增加648g,则甲池中理论上消耗O2_______L(标准状况下)。
(3)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为 。
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z、W是常见金属,Z的氧化物可做耐火材料,W的简单离子是同周期中离子半径最小的,Q的p能级上有一个未成对电子.试回答下列问题:
(1)比较第一电离能:Z_________W(填“>”、“<”或“=”,后同);电负性:X________Y。
(2)写出Q的价电子排布图_____________,YF3的结构式_____________,
(3)向硫酸铜溶液中逐滴滴入Y的氢化物的水溶液至过量,用离子方程式表示该过程出现的现象变化:答:________________________________________。
Ⅰ.图1是某压强下工业合成氨生产过程中,N2与H2按体积比为1:3投料时,反应混合物中氨的体积分数随温度的变化曲线,其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。
(1)图中表示该反应的平衡曲线的是__________(填“Ⅰ”或“Ⅱ”);由图中曲线变化趋势可推知工业合成氨的反应是___________(填“吸热”或“放热”)反应。
(2)图中a点,容器内气体n(N2):n(NH3)= ____________,图中b点,v(正)_________v(逆)(填“>”、“=”或“<”)。
Ⅱ.以工业合成氨为原料,进一步合成尿素的反应原理为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)
CO(NH2)2(l)+H2O(g)
工业生产时,需要原料气带有水蒸汽,图2中曲线I、Ⅱ、Ⅲ表示在不同水碳比[n(H2O)/n(CO2)]时,CO2的转化率与氨碳比[n(NH3)/n(CO2)]之间的关系。
(1)写出该反应的化学平衡常数表达式____________________
(2)曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是_________,判断依据是_______________
(3)测得B点氨的转化率为40%,则x1=__________。
X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
| X |
Y |
|
| |
Z |
W |
请回答下列问题:
(1)W位于周期表中第__________周期,第________族;
(2)X可形成双原子分子,其分子的电子式是___________;Y和氢元素形成的10电子微粒中常见的+1价阳离子为_________(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为__________;
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式______________________。
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式是_____________。
工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下:
试回答下列问题:
(1)滤液X中含有的金属阳离子是______________(填离子符号)。
(2)步骤Ⅲ中可选用________调节溶液的pH(填字母)。
| A.稀硫酸 | B.氨水 |
| C.氢氧化钠溶液 | D.高锰酸钾溶液 |
(3)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是______________。
(4)步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是__________________________。
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为_________________________。
食品安全一直是社会关注的话题.过氧化苯甲酰( )过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图:
)过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图: 苯乙烯
苯乙烯
请回答下列问题:
(1)写出反应③的化学方程式:___________;过氧化苯甲酰在酸性条件下水解的化学方程式为________;
(2)下列有关苯乙烯的说法正确的是__________(填字母序号);
a.苯乙烯能使溴水褪色
b.苯乙烯存在一种同分异构体,其一氯代物仅有一种
c.苯乙烯分子中8个碳原子可能共平面
d.苯乙烯、庚烷燃烧耗氧量肯定相等
(3)苯甲酰氯( )能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称________________;
)能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称________________;
(4)写出一个符合下列要求的过氧化苯甲酰的同分异构体的结构简式________________;
①分子中不含碳碳双键或叁键;②分子中只含有一种含氧官能团;③核磁共振氢谱有3组峰,其峰面积之比为1:2:2
某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)上述(B)操作的目的是______________________。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填“偏大”、“偏小”或“不变”,下同)_________________________。
(4)实验中用左手控制滴定管活塞,眼睛注视______________________,直至滴定终点,判断到达终点的现象是: 。
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是 。
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是 。
银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。回答下列问题。
(1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是 。
A.Ag与空气中的氧气反应生成氧化银
B.Ag与空气中的含硫化合物反应生成硫化银
C.Ag与空气中氧及含硫化合物反应生成硫化银
(2)已知Ksp(AgCl)=1.8×10-10,若向50mL 0.018mol·L-1的AgNO3溶液中加入50mL 0.020mol·L-1的盐酸,混合后溶液中的Ag+的浓度为 mol·L-1,pH为 。
(3)AgNO3溶液光照易分解,生成Ag和红棕色气体等物质,其光照分解的化学方程式为 。
(4)如图下所示原电池正极的反应式为 。

在标准状况下充满HCl的烧瓶做完喷泉实验后得到稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,请你回答下列问题:
(1)用标准Na2CO3溶液滴定这种盐酸时,Na2CO3溶液应装在___________式滴定管中,若用甲基橙作指示剂,达到滴定终点时,溶液从___________色变为___________色。
(2)现配制三种浓度的标准Na2CO3溶液,你认为最合适的是下列第___________种(填序号)。
①2.500 mol·L-1 ②0.25 mol·L-1 ③0.025 mol·L-1
(3)若采用上述合适浓度的标准Na2CO3溶液滴定,用c(Na2CO3)表示,滴定时实验数据列表如下:
| 实验编号 |
待测盐酸体积(mL) |
滴入Na2CO3溶液体积(mL) |
| 1 |
20.00 |
18.80 |
| 2 |
20.00 |
16.95 |
| 3 |
20.00 |
17.05 |
求这种待测稀盐酸的物质的量浓度(用数据和符号列式即可):c(HCl)=________。
(4)用A.偏高;B.偏低;C.无影响;D.无法判断,填写下列各项操作会给实验造成的误差。
①开始滴定时,滴定管尖端处有气泡,滴定完毕气泡排出( )
②滴定前读数时仰视,滴定完毕读数时俯视( )
在A、B两只烧杯中,依次分别盛有NaOH溶液、煮沸的蒸馏水,各滴入几滴饱和FeCl3溶液,试根据实验现象分别回答以下问题:
(1)分别写出两只烧杯中形成分散系的名称:A________,B________。
(2)写出A中形成分散系的离子方程式:________。
(3)写出B中形成分散系的化学方程式:________。
由中国科研人员从中药材中提取的金丝桃素对感染H7N9禽流感的家禽活体具有一定的治愈率。金丝桃素的结构简式如下:

请回答下列问题:
(1)金丝桃素能在NaOH溶液中加热反应得A和B,已知B为芳香族化合物,则A的分子式是________;
(2)室温下,B 用稀盐酸酸化得C,C中含氧官能团的名称是________;
(3)两分子C与浓H2SO4共热,可生成含有八元环的化合物,该反应的反应类型是________;
(4)写出一种符合下列条件的C的同分异构体的结构简式________;
①苯环上只有一个支链 ②含有醛基 ③1mol该有机物与足量金属钠反应产生1mol气体
氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下:
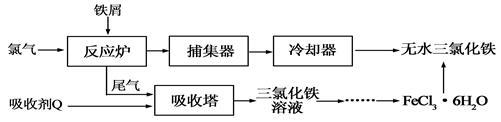
(1)试写出吸收塔中吸收剂Q反应的离子方程式: 。
(2)六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| 溶解度(g/100gH2O) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是:加入少量盐酸、 、 、过滤、洗涤、干燥。再由FeCl3·6H2O晶体得到无水FeCl3的操作是: 。
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)= mol·L-1。(常温下Ksp[Fe(OH)3]=4×10-38)。
(4)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式 。
(5)向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学 。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释 。
在一密闭容器中加入A、B进行可逆反应:A(g) + B(g) m C(g)(m为整数), A的转化率(αA)与温度(T)、压强的关系如图所示:
m C(g)(m为整数), A的转化率(αA)与温度(T)、压强的关系如图所示:
(1)此反应的正反应是_______________ (填“放热”、“吸热”)反应;
(2)m值为__________;
(3)若保持其它条件不变,升高温度,混合气体的平均相对分子质量_________ (填“增大” “减小”或“不变”);
某温度下,纯水中c(H+) = 2×10-7 mol•L-1,则此温度____________25°C(填“>”、“<”或“=”)。若温度不变,滴入稀盐酸,使c(H+) = 8×10-4 mol•L-1,则此时溶液中由水电离产生的c(H+) =____________。